1.钢在空气中加热的氧化和脱碳
空气中有大量的氧气,氧气是一种很活泼的气体,在高温下能和铁发生一系列的氧化反应,诸如
2Fe+O2=2FeO (3-1)
4Fe+3O2=2Fe2O3 (3-2)
3Fe+2O2=Fe3O4 (3-3)
这些过程不可逆,因而不能控制。所以在中性、惰性气氛和可控气氛中从原理上都不允许氧气的存在。按照氧化铁结合自由能关系,在高温下要使钢完全不氧化,必须使气体介质中氧的质量分数降低到百万分之一以下。
图3-48所示为铁-氧系的平衡状态图。铁氧化层内的氧浓度分布和氧化过程示于图3-49。
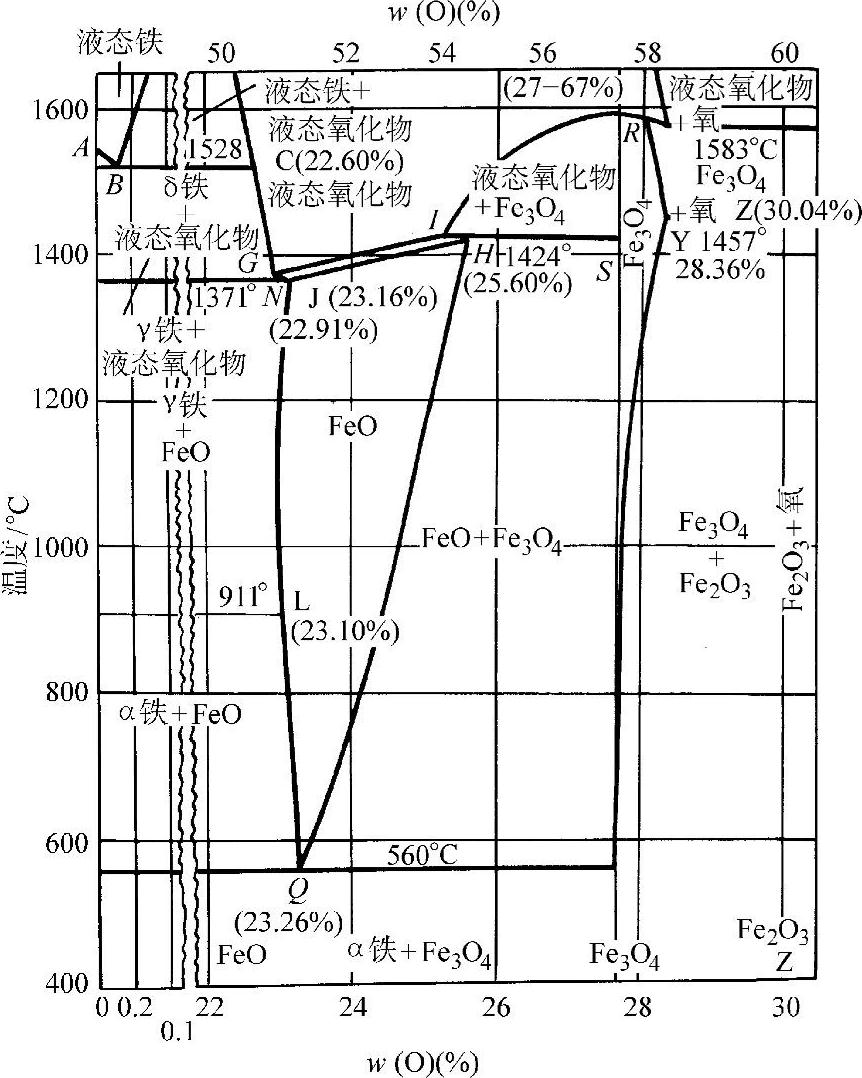
图3-48 铁-氧平衡状态图
在570°C以上紧贴金属表面的一层是FeO,而在570°C以下为Fe3O4。图3-50所示为纯铁的氧化增重和温度、时间的关系。纯铁在氧气中的氧化增重与时间平方根的线性关系示于图3-51。图3-52所示为纯铁在1200°C的空气中发生氧化时各氧化层的成长曲线。纯铁和各种含碳量的钢在空气中加热时的氧化减重随温度的变化示于图3-53。钢中的合金元素对于钢在高温下的抗氧化能力有不同的影响。Ti、V、W、Mo、Co、Ni、Cu等金属可改善钢的力学性能,但对抗氧化能力影响不大(见图3-54和图3-55)。钢中的碳对抗氧化能力的影响也不显著。Cr、Al、Si能显著提高钢的抗氧化能力,因此是耐热不起皮钢的主要添加元素。图3-56所示分别为C、Cr、Al、Si对钢在不同温度下在空气中氧化量的影响。
作为电热材料的Fe-Cr-Al合金具有很高的抗高温氧化能力。图3-57所示各种成分的Fe-Cr-Al合金在不同温度下加热10min的氧化减重。
纯镍的抗氧化能力不强,添加适当合金元素可显著提高合金在高温下的抗氧化性能。在这些元素中铬具有最强烈的影响,因此镍铬合金便成为最常用的高温抗氧化材料。图3-58所示为镍铬合金的高温氧化增重和含铬量的关系。

图3-49 氧化层内的氧浓度分布和氧化过程
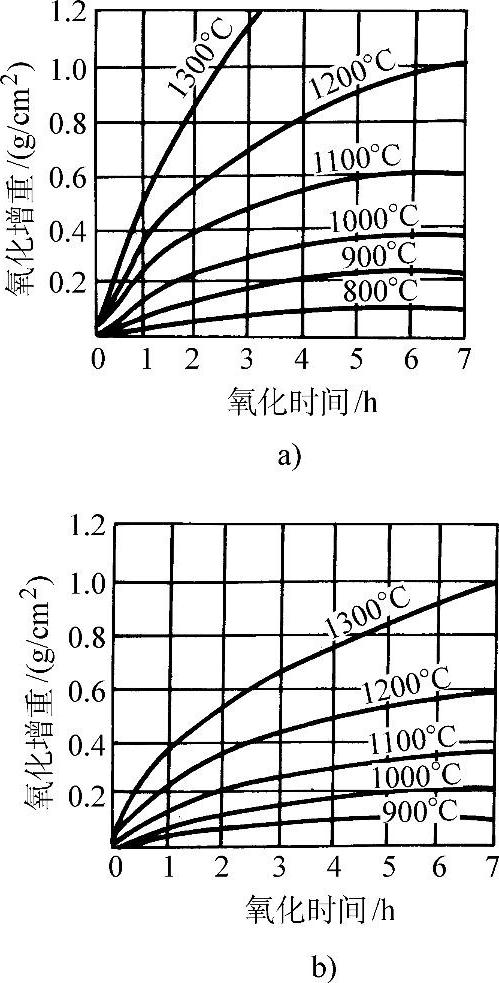
图3-50 纯铁的氧化增重和温度、时间的关系
a)在纯氧中 b)在空气中
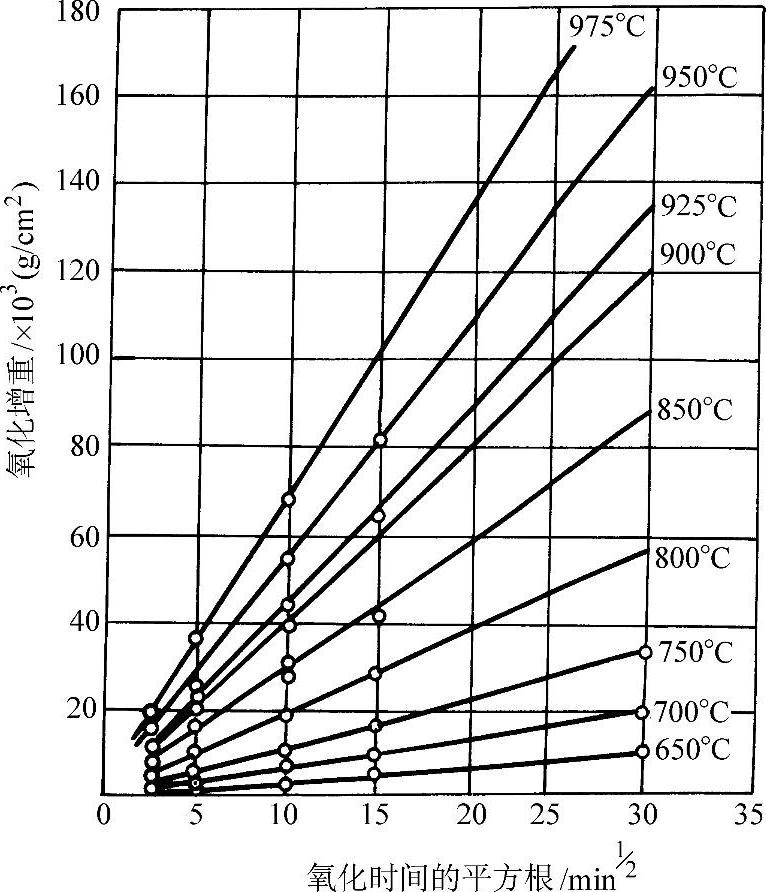
图3-51 纯铁在氧气中的氧化增重与时间平方根的线性关系
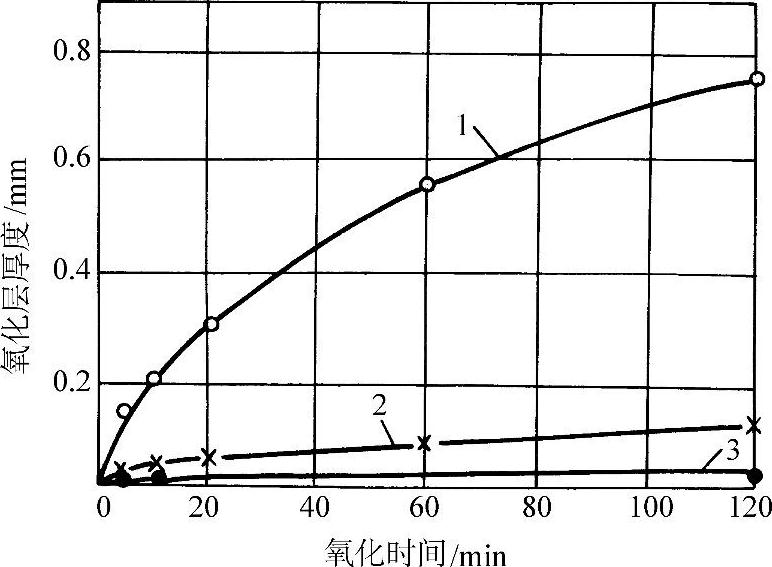
图3-52 纯铁在1200°C的空气中发生氧化时各氧化层的成长曲线
1—内层FeO 2—外层Fe3O4 3—最外层Fe2O3
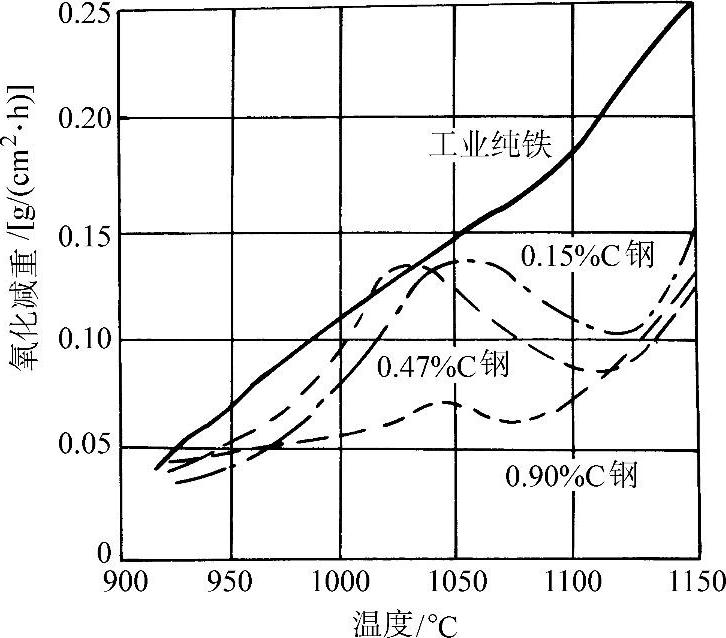
图3-53 纯铁及各种含碳量的钢在空气中加热时的氧化减重随温度的变化
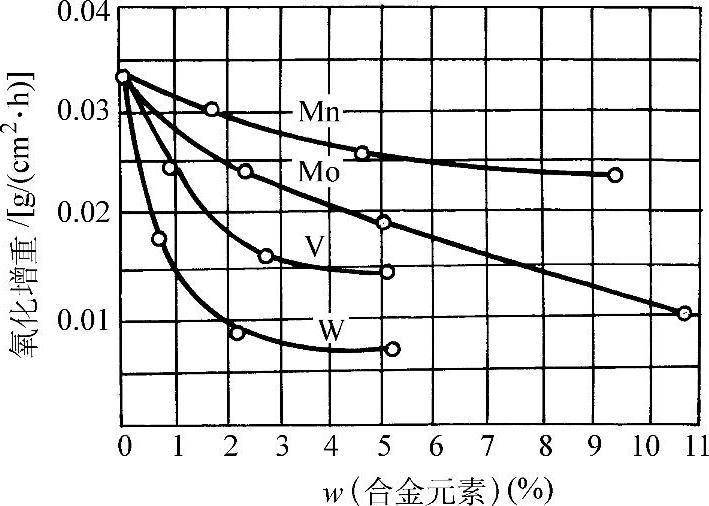
图3-54 添加Mn、Mo、W、V对铁高温氧化增重的影响(1000°C,1h)
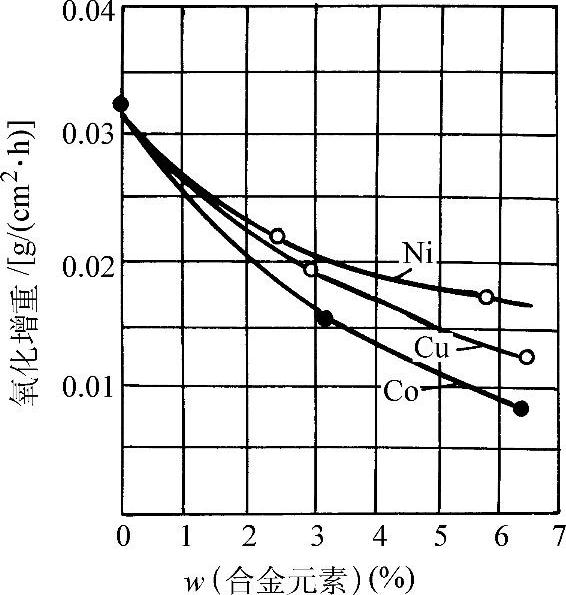
图3-55 添加Ni、Cu、Co对铁高温氧化增重的影响(1000°C,1h)
钢铁在空气中加热,在发生氧化的同时也会形成脱碳,即奥氏体中的溶解碳和碳化物中的结合碳的烧损,其反应式为
C(γ-Fe)+O2=CO2 (3-4)
Fe3C+O2=3Fe+CO2 (3-5)
这些反应是不可逆的,因此也是不能控制的。因此在惰性气体或可控气氛中要防止脱碳,原理上不允许有氧的存在。图3-59所示为w(C)=0.85%钢在空气中加热1h的氧化脱碳层厚度随温度的变化。
2.钢在CO-CO2气氛中的氧化和脱碳
二氧化碳是燃烧产物中的主要成分,在高温会引起钢的氧化脱碳,但对铜却几乎没有氧化作用,因之是铜及铜合金退火加热时的优良保护气体。
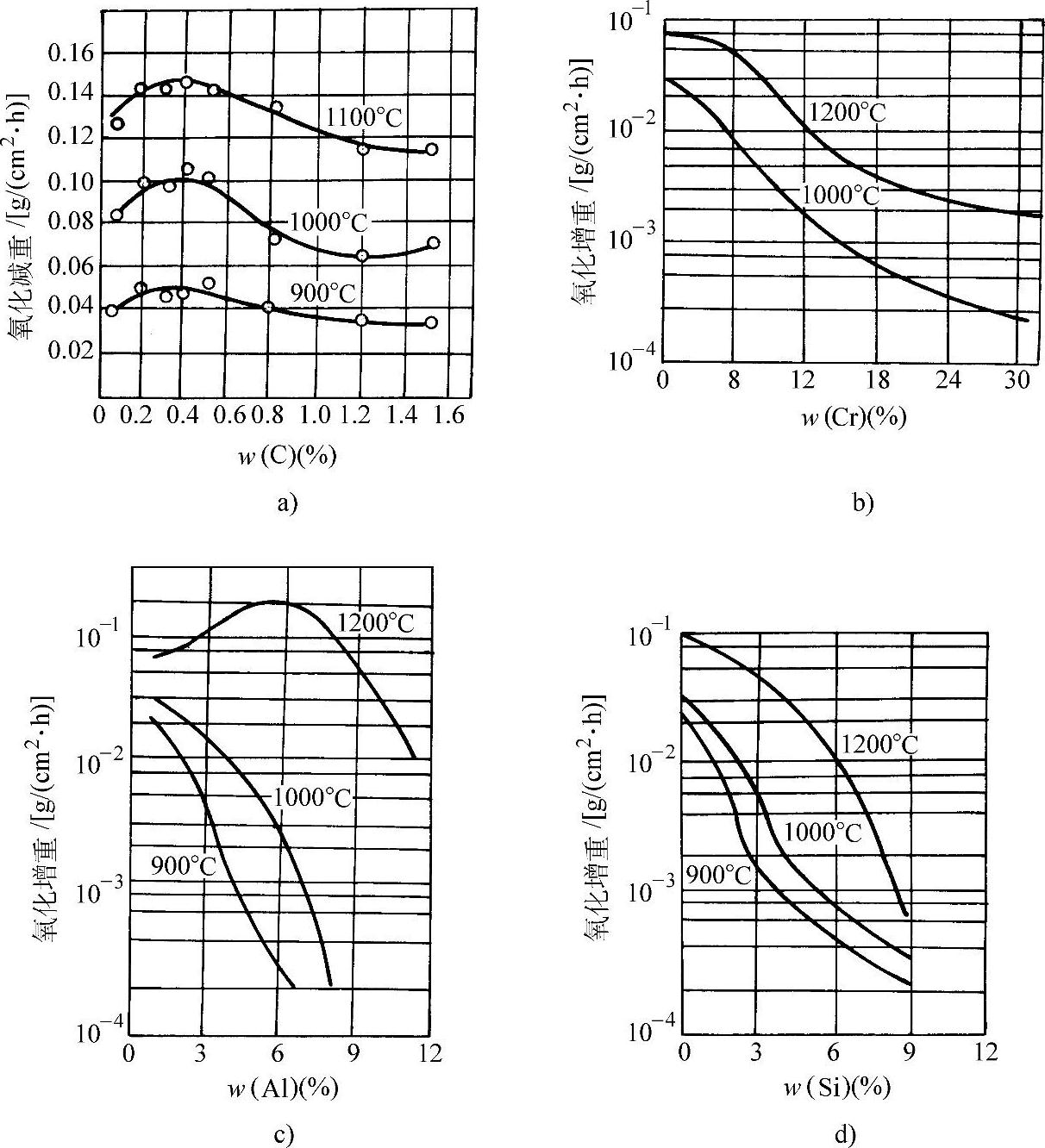
图3-56 C、Cr、Al、Si对钢在不同温度下在空气中氧化量的影响(加热1h)
a)C的影响 b)Cr的影响 c)Al的影响 d)Si的影响
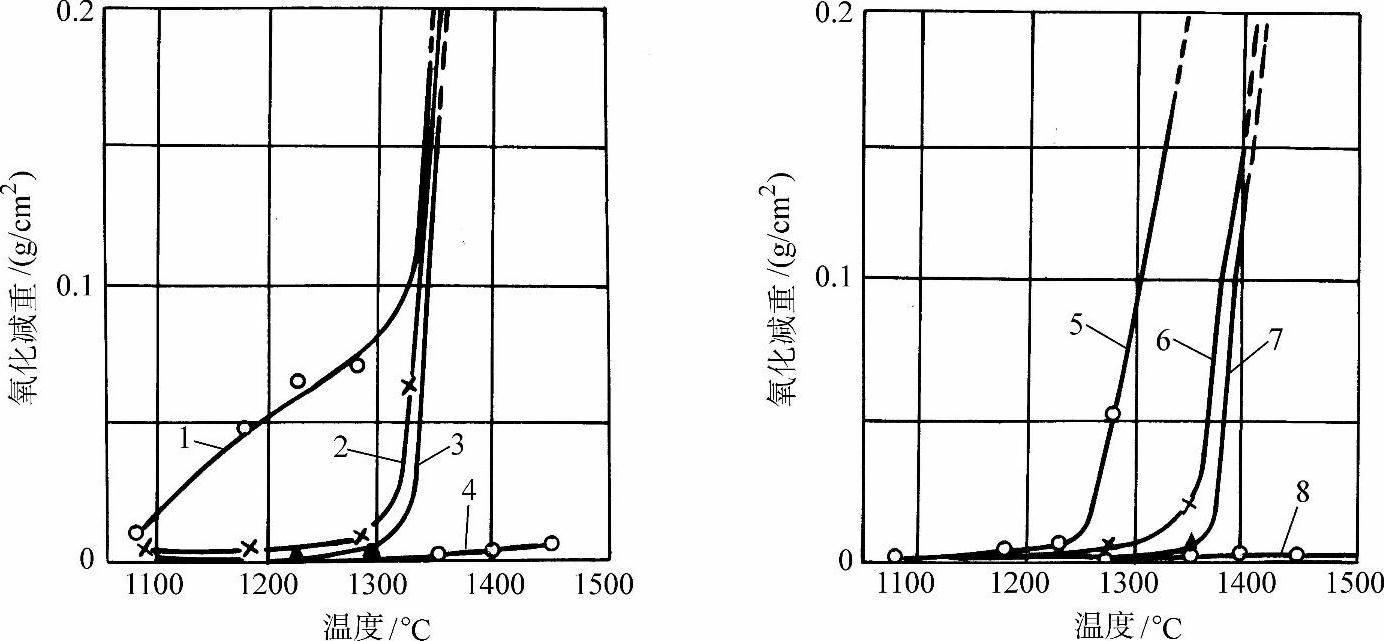
图3-57 各种成分的Fe-Cr-Al合金在不同温度下加热10min的氧化减重
1—w(Cr)=5.00%,w(Al)=1.37% 2—w(Cr)=9.5%,w(Al)=1.33% 3—w(Cr)=15.02%,w(Al)=1.11% 4—w(Cr)=19.39%,w(Al)=1.30% 5—w(Cr)=4.15%,w(Al)=3.39% 6—w(Cr)=7.49%,w(Al)=2.99% 7—w(Cr)=12.81%,w(Al)=3.28% 8—w(Cr)=17.20%,w(Al)=3.48%
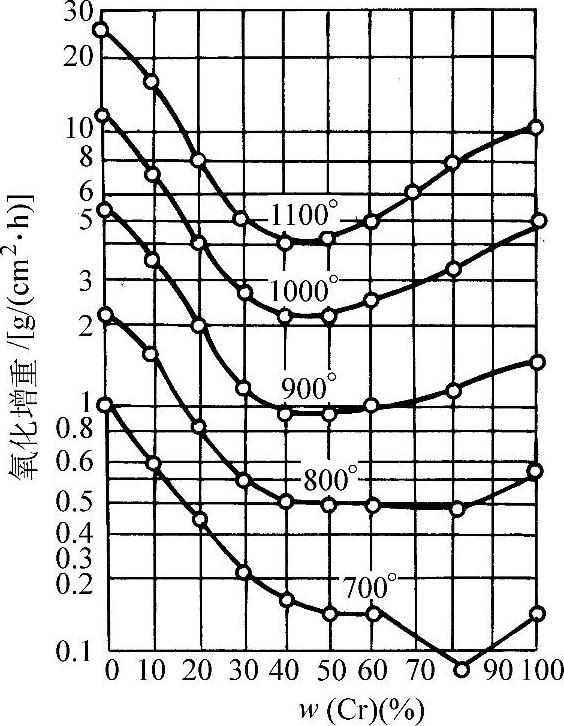
图3-58 镍铬合金的高温氧化增重和含铬量的关系
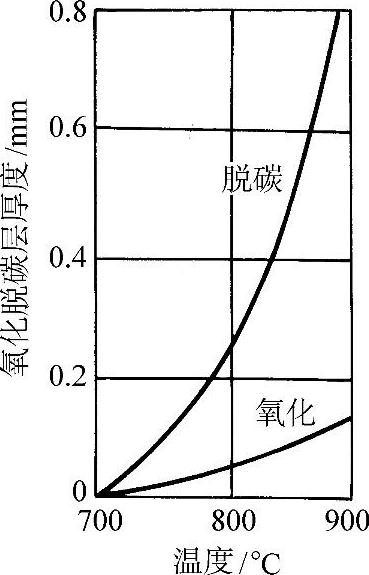
图3-59 w(C)=0.85%钢在空气中加热1h的氧化脱碳层厚度随温度的变化
一氧化碳是不完全燃烧产物,在高温下对钢表面有还原作用,因而也是渗碳气体的主要成分,可使钢表面增碳。
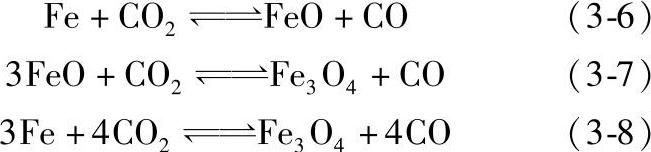
在570°C以上,反应按式(3-6)、式(3-7)进行,在此温度以下主要是按式(3-8)进行。这些反应是可逆的,其反应的方向取决于混合气体中CO2/CO的比例,因而是可以控制的。
图3-60为铁在CO-CO2气氛中于各种温度下的氧化、还原平衡曲线。
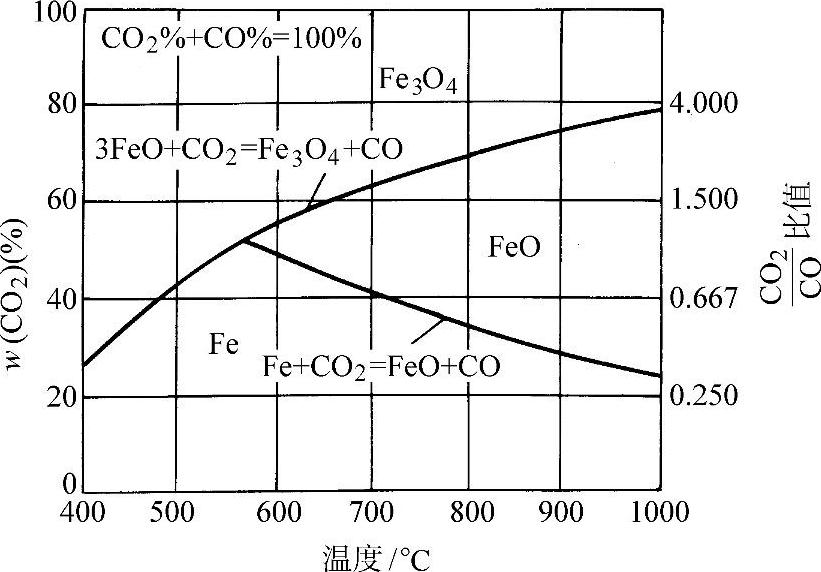
图3-60 铁在CO-CO2气氛中于各种温度下的氧化、还原平衡曲线
钢在CO-CO2气氛中的脱碳、增碳反应如下:
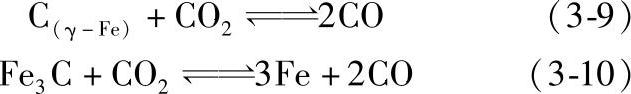
该反应进行的方向,即产生脱碳或是增碳的效果亦取决于CO2/CO的比例。CO-CO2气氛对钢的脱碳、增碳平衡曲线示于图3-61。
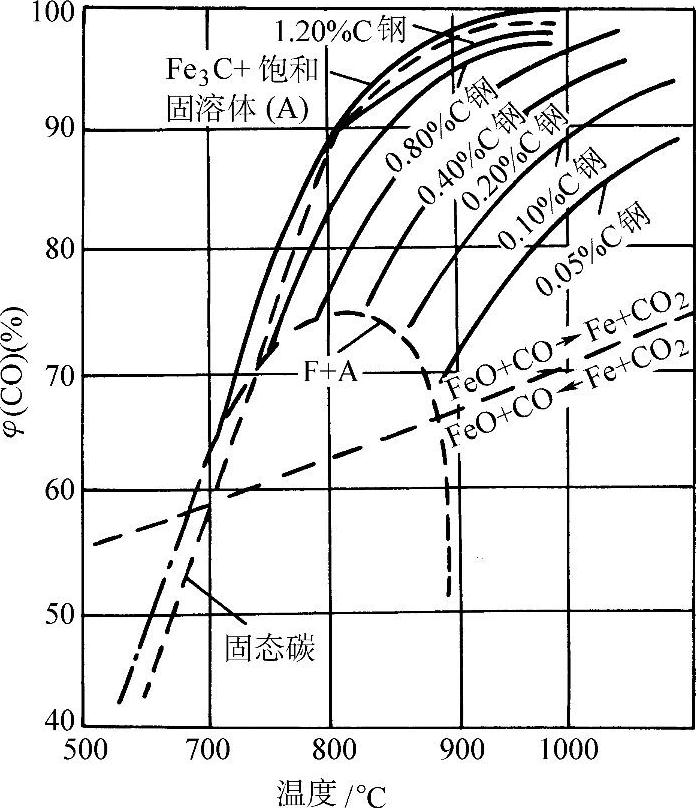
图3-61 CO-CO2气氛对钢的脱碳、增碳 平衡曲线(pCO+pCO2=0.1MPa)
图3-62~图3-64所示为低碳钢在CO2+CO、CO2+H2、CO2+N2的混合气体中加热3h的氧化损失量。
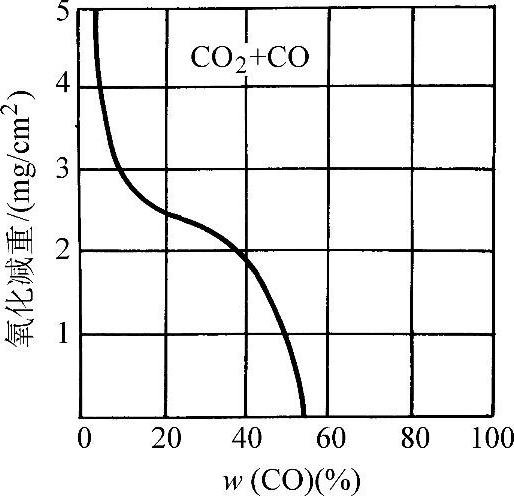
图3-62 低碳钢在CO2+CO混合气体中于1000°C加热3h的氧化损失量
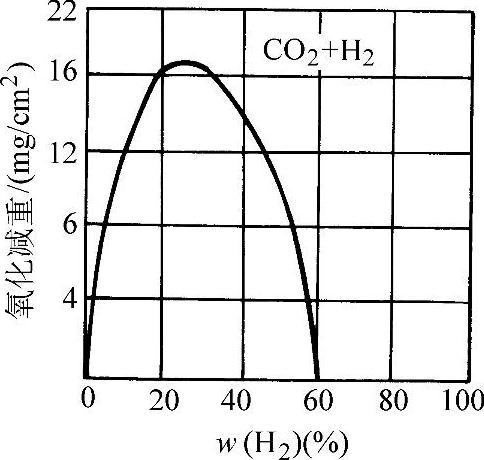
图3-63 低碳钢在CO2+H混合气体中于1000°C加热3h的氧化损失量
 (https://www.xing528.com)
(https://www.xing528.com)
图3-64 低碳钢在CO2+N2混合气体中加热3h的氧化损失量
图3-65所示为w(C)=0.85%钢在CO2中加热1h的氧化与脱碳层厚度随温度的变化。
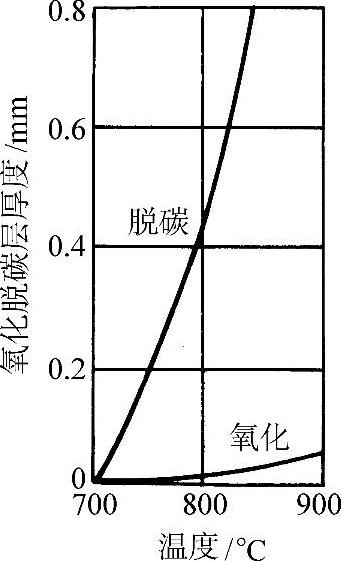
图3-65 w(C)=0.85%钢在CO2中加热1h的氧化与脱碳层厚度随温度的变化
钢中的铬与二氧化碳会发生如下的氧化反应:
2Cr+3CO2=Cr2O3+3CO (3-11)
此反应平衡曲线示于图3-66中。由曲线可看出,要使铬在700°C不发生氧化的条件是:p(CO)/p(CO2)>105。而p(CO)/p(CO2)在700°C的平衡比值为2.3(图3-66中的曲线C),亦即p(CO)/p(CO)2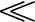 105这样的气体净化程度在实际上是达不到的,所以铬、铬合金以及含铬钢在CO-CO2气氛中不可能实现无氧化加热。
105这样的气体净化程度在实际上是达不到的,所以铬、铬合金以及含铬钢在CO-CO2气氛中不可能实现无氧化加热。
3.钢在H2-H2O气氛中的氧化和脱碳
水蒸气在高温下对钢有氧化和脱碳作用。而氢是一种还原性气体,在高温下可使钢表面的氧化物还原。钢在H2-H2O气氛中加热时的氧化还原反应如下:
Fe+H2O FeO+H2 (3-12)
FeO+H2 (3-12)
3FeO+H2O Fe3 O4+H2 (3-13)
Fe3 O4+H2 (3-13)
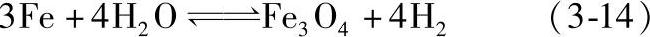
反应式(3-12)、式(3-13)是在570°C以上进行的。在570°C以下主要发生式(3-14)反应。这些反应是可逆的,因而也是可以控制的。反应发展的方向取决于反应温度下的H2-H2O气体平衡常数。图3-67所示为铁在H2-H2O气氛中加热时的氧化、还原平衡状态图。
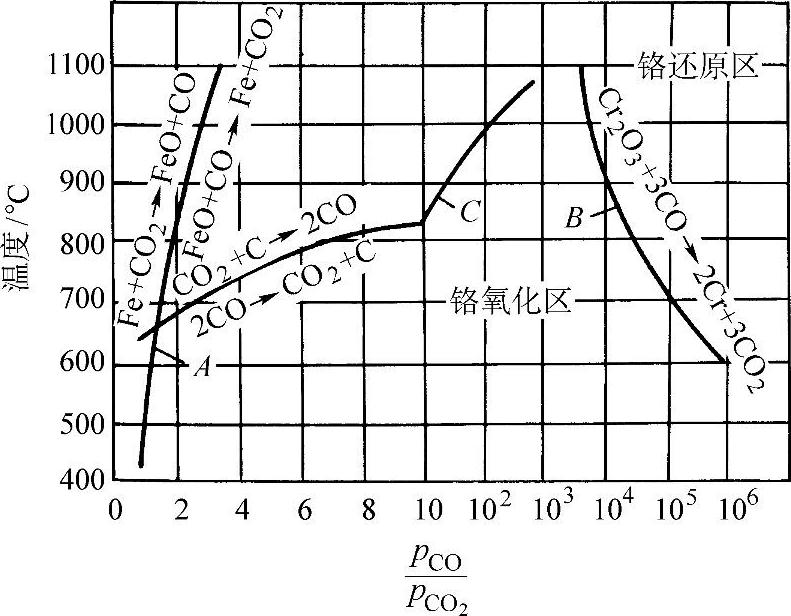
图3-66 CO-CO2气氛和铁、铬的平衡曲线
pCO—CO在气体中的分压pCO2—CO2在气体中的分压
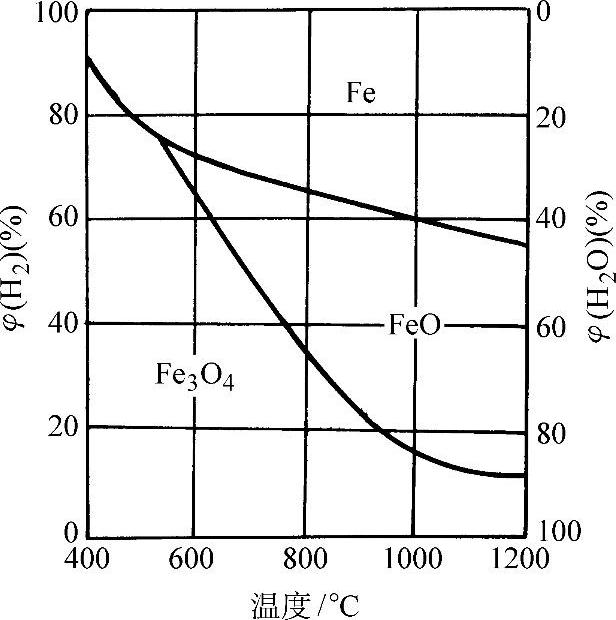
图3-67 铁在H2-H2O气氛中加热时的氧化、还原平衡状态图
H2-H2O气体在高温下会引起钢的脱碳,其反应如下:
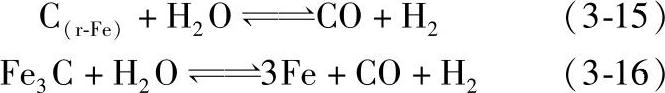
水蒸气对钢的脱碳反应产物中有CO,这些反应又是可逆的,因此在H2-H2 O气氛中添加CO可使反应向相反方向进行,即达到增碳效果。图3-68所示为钢在H2-H2O-CO气氛中加热时的脱碳与增碳平衡状态图。
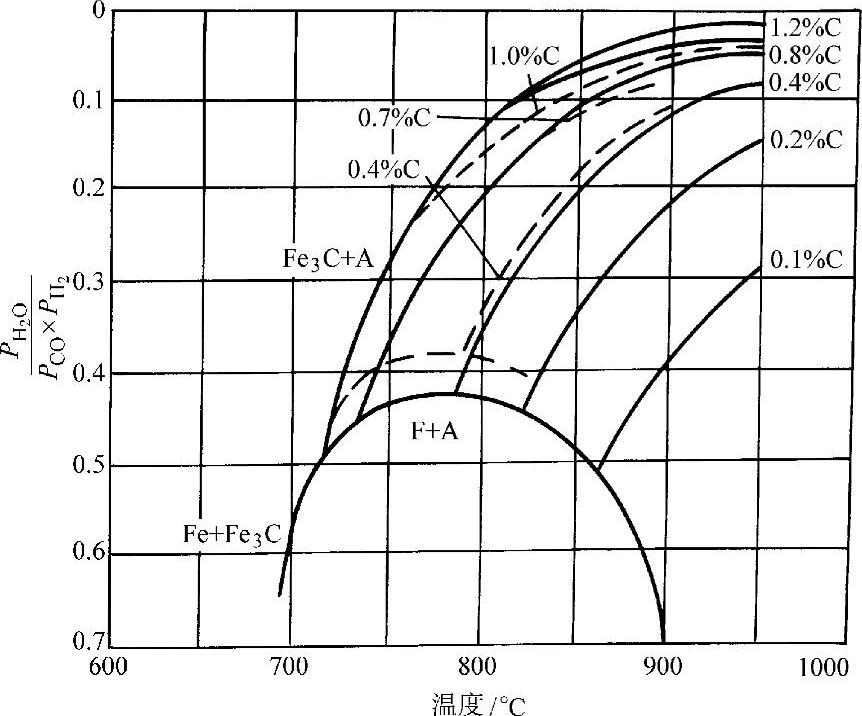
图3-68 钢在H2-H2O-CO气氛中加热时的脱碳与增碳平衡状态图
虚线—实验数据 实线—计算数据
图3-69为纯铁在水蒸气中于不同温度下的氧化增重与时间的关系。水蒸气对铁的氧化速度比氧、空气、二氧化碳等气体大。纯铁在1000°C于各种气体中加热时,FeO厚度与时间的关系示于图3-70。
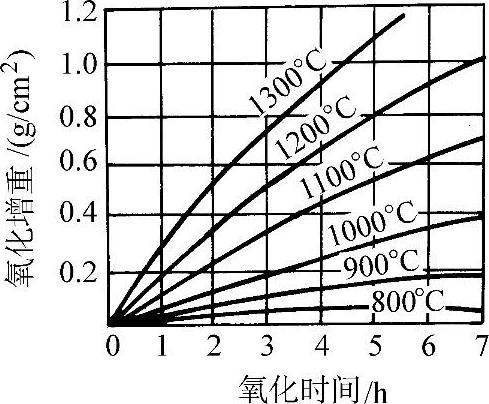
图3-69 纯铁在水蒸气中于不同温度下的氧化增重与时间的关系
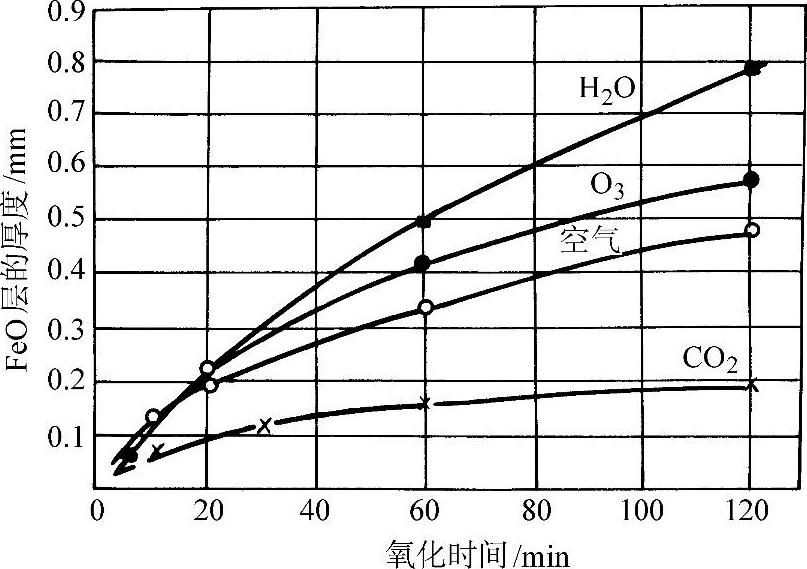
图3-70 纯铁在1000°C于各种气体中加热时,FeO厚度与时间的关系
图3-71为w(C)=0.85%钢在水蒸气中加热1h的氧化脱碳层厚度随温度的变化。由此可知,在750°C以下钢在水蒸气中几乎不脱碳,但在800°C以上脱碳层显著增加。钢在水蒸气、空气和二氧化碳中加热时的氧化速度依此排列逐步减小,而脱碳速度的顺序则正好相反。但三种气体的脱碳速度都比氧化速度大。
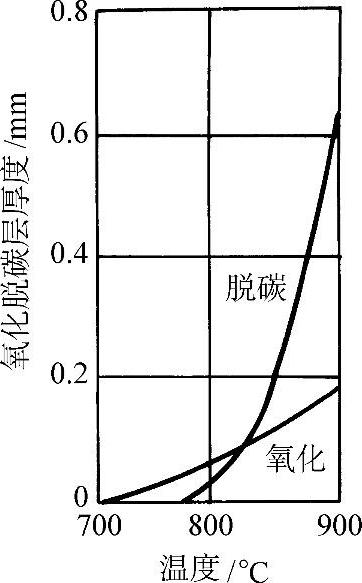
图3-71 w(C)=0.85%钢在水蒸气中加热1h的氧化脱碳层厚度随温度的变化
氢对钢有脱碳作用。脱碳程度取决于炉温、含水量、在高温保持时间以及钢的碳含量。干燥氢的脱碳作用很小,因为纯氢在高温下对钢脱碳速度很慢。随氢中含水量的增加,脱碳作用显著增加(见图3-72)。
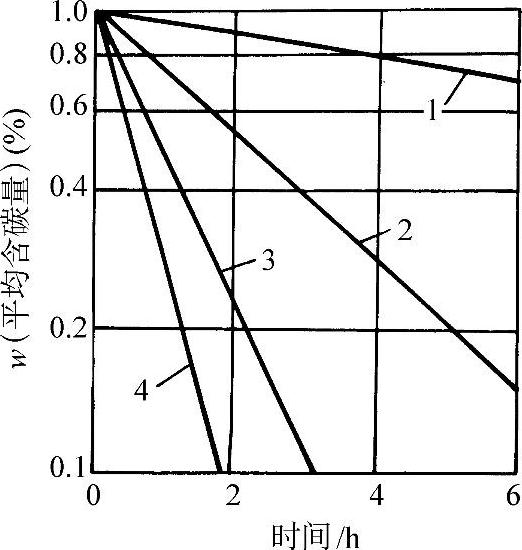
图3-72钢在H2-H2O气体中的脱碳(厚度1mm钢片,1000°C处理)
1—干燥H2 2—p(H2O)133.322Pa 3—p(H2O)666.61Pa 4—p(H2O)26666.44Pa
氢对钢的加热脱碳作用随温度升高而加剧,特别是在700°C以上,脱碳效应剧烈增加(见图3-73)。w(C)=1.08%钢在H2-H2O气氛中于1000°C加热20h的脱碳情况示于图3-74。

图3-73 钢在纯氢中的脱碳(加热时间16h)
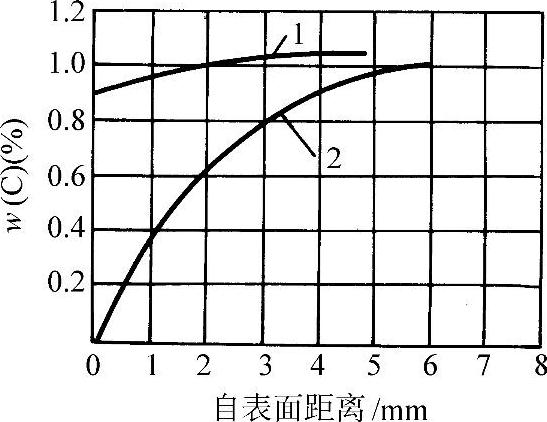
图3-74 w(C)=1.08%钢在H2-H2 O气氛中于1000°C加热20h的脱碳情况
1—干燥氢 2—在18°C饱和水的氢(16.4g/m3)
40钢在850°C于H2-H2O-N2气氛中的脱碳层深度和气氛中含水量的关系示于图3-75。在850°C的脱碳层深度随时间变化示于图3-76。
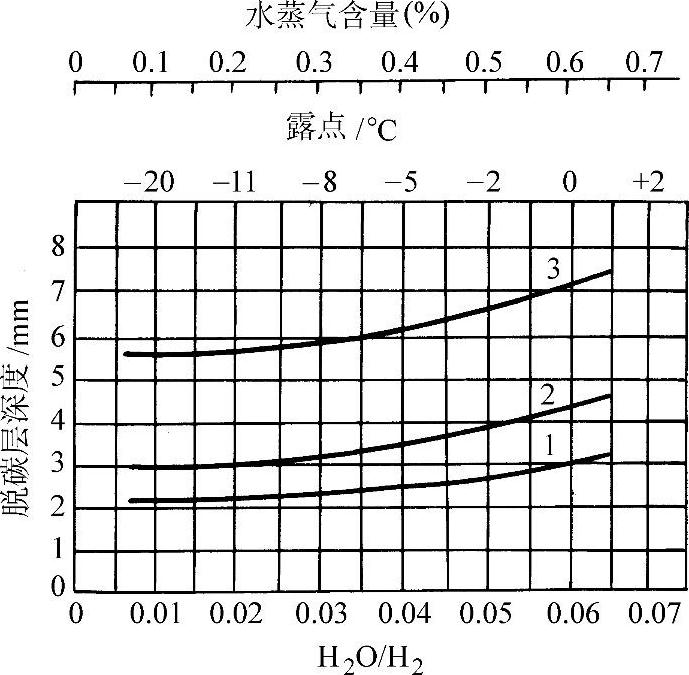
图3-75 40钢脱碳层深度和H2-H2O-N2气氛温度的关系(850°C)
1—0.5h 2—1h 3—3h
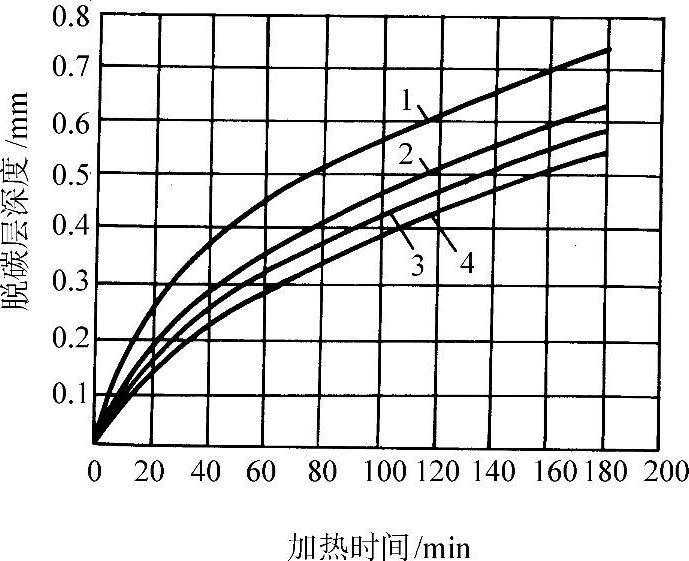
图3-76 40钢脱碳层厚度和加热时间的关系(加热温度850°C:炉内气氛H28%~12%,其余N2)
1—H2O/H2=0.065 2—H2O/H2=0.045 3—H2O/H2=0.033 4—H2O/H2=0.025
4.含硫气体对钢的作用
炉气中的硫化物大都是由燃料带入的。硫化物存在的形式有:硫化氢(H2S)、二氧化硫(SO2)或三氧化硫(SO3)、硫醇(C2H5SH)、硫茂(C4H4S)以及金属硫化物等。在一些情况下燃料中也会出现游离硫。在还原性气氛中的硫一般以硫化氢形式存在,后者是通过以下反应生成的:

在氧化性气氛中的硫则发生以下反应:
C4H4S+6O2——→4CO2+2H2 O+SO2
2SO2+3Fe+2Ni——→Fe2O3+NiS+NiO+FeS
当高镍钢在上述含硫气氛中加热时,会同时产生硫化镍和氧化镍,形成鳄鱼皮状表面。含硫炉气会加速金属的氧化,并随着温度的升高而进一步加剧。此外气体硫化物对人的健康极为有害,散入大气会造成环境及大气污染,后果严重。因此在热处理炉中应采用低硫燃料或预先采取除硫措施。而制备可控气氛的燃料中的含硫量必须严格控制在180mg/m3以下。
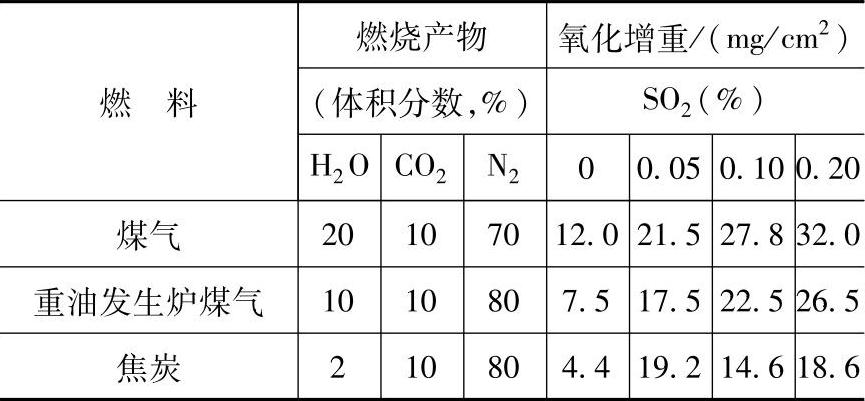
表3-17所列为在各种燃料的燃烧产物中加入SO2气体对钢材氧化性能的影响。
表3-17在各种燃料的燃烧产物中添加不同量的 SO2气体对钢材氧化性能的影响
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




