从以上实验结果可以看出,在无任何辅助萃取剂存在下,离子液体BtmsimPF6可直接萃取血红蛋白,这表明离子液体与血红蛋白间可能发生了一定的相互作用,因此实验中通过光谱分析对其可能的萃取机理进行了探讨。
4.3.6.1 静电吸引作用
血红蛋白的等电点为6.8,当溶液的pH小于其等电点时,血红蛋白表面带正电荷,而当溶液的pH大于其等电点时,血红蛋白表面带负电荷,因此从理论上说,如果血红蛋白与离子液体之间存在静电吸引作用,则改变pH时血红蛋白的表面电荷会发生改变并导致萃取率的变化。
实验中考察了不同pH(2~9)条件下离子液体对血红蛋白的萃取结果,如图4-7所示。萃取前,随着血红蛋白水溶液pH的变化,血红蛋白的吸光度也发生变化,同时最大吸收波长也发生明显改变[图4-7(a~d)]。这表明在不同的pH条件下,血红蛋白的表面电荷及构型发生改变,同时构型的变化导致血红蛋白的疏水性基团和血红素基团所处的疏水性环境发生变化。因此,其吸光度的大小和最大吸收波长都发生明显改变[26]。图4-7(e~h)为萃取后,血红蛋白水溶液的吸光度。从图中可以看出,萃取后的血红蛋白水溶液在406nm处的吸光度大小几乎相同,尽管溶液pH改变,但是离子液体对血红蛋白的萃取率没有变化,这表明离子液体与血红蛋白之间的静电吸引作用对离子液体萃取血红蛋白作用不大,静电吸引作用并不是离子萃取血红蛋白的驱动力。
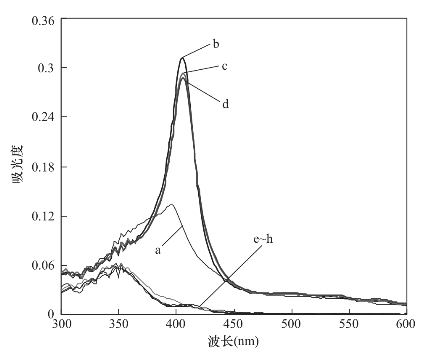
图4-7 血红蛋白水溶液的UV-Vis光谱
萃取前:a~d,pH分别为2,4,7,9;萃取后:e~h,pH分别为2,4,7,9;血红蛋白浓度为50ng/μL,体积为3mL;IL体积为400μL;萃取时间为30min。
4.3.6.2 共价配位作用
离子液体萃取不同种类蛋白质的研究结果表明,不含血红素基团的蛋白(白蛋白、转铁蛋白)完全不能被离子液体萃取;而细胞色素C在一定条件下可被离子液体萃取;血红蛋白、肌红蛋白能够直接被三种离子液体萃取。比较以上萃取的蛋白质,发现含有血红素的蛋白(血红蛋白、肌红蛋白、细胞色素C)能被离子液体萃取。实验中又对脱辅基肌红蛋白、肌红蛋白的萃取进行了研究,结果表明,肌红蛋白可被离子液体萃取,而脱辅基肌红蛋白完全不能被离子液体萃取。这两种蛋白质最明显的区别是脱辅基肌红蛋白不含血红素基团。
采用不同烷基侧链的离子液体萃取血红蛋白的研究结果表明,随着离子液体阳离子的烷基侧链长度增加,血红蛋白的萃取率增大,这表明离子液体的阳离子结构对血红蛋白的萃取也有明显影响。离子液体阳离子上的烷基侧链增大,从性质上来说导致其疏水性更强;从结构上来说,使咪唑阳离子的电荷分布更均匀,具有更强的得电子能力,其配位能力也明显增强。
从以上分析可以看出,血红素分子和离子液体阳离子结构对血红蛋白的萃取都有显著影响。在血红蛋白中血红素的铁原子为五配位结构,除了与卟啉的4个吡咯氮原子共价配位构成血红素的平面骨架结构(图4-8),还与邻近的组氨酸的咪唑氮原子配位,第六个配位键可与其他的小分子(O2、CO、H2O)结合[28],当有合适的配体存在时,血红素中的铁原子会与其发生配位结合[27-29]。相关文献[27]已报道咪唑是一个较强的共价配体,可与血红素分子中的铁原子发生配位作用。在离子液体BtmsimPF6中咪唑的烷基侧链为强吸电子基团丁基和三甲基硅,与咪唑相比离子液体的阳离子Btmsim+具有更强的配位能力。因此在萃取过程中,离子液体的阳离子Btmsim+可能与血红蛋白中血红素中的铁原子发生配位结合。

图4-8 血红素的分子结构式
基于以上分析,推测离子液体BtmsimPF6萃取血红蛋白的机理可能是:离子液体中的咪唑阳离子Btmsim+与血红蛋白中血红素的铁原子发生配位结合,生成的Btmsim+-heme复合物被萃取到离子液体相中(图4-9)。为了证明这个萃取机理,实验中对离子液体与血红蛋白的紫外—可见光谱、荧光光谱、57Fe穆斯堡尔谱、圆二色光谱进行了研究。
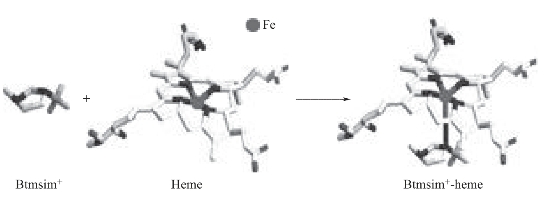
图4-9 离子液体BtmsimPF6萃取血红蛋白的萃取机理
4.3.6.3 紫外—可见光谱
根据提及的萃取机理,可以推断在萃取过程中血红蛋白中血红素分子的结构可能会发生改变,因此,实验中对血红蛋白萃取前及被萃取到离子液体中后进行了紫外—可见吸收光谱测定,如图4-10所示。图4-10(a)为血红蛋白浓度250ng/μL时的吸收光谱,从图中可以看出,在水溶液中血红蛋白在406nm处有吸收,该波长的光吸收主要是血红蛋白中血红素分子的吸收峰,而当血红蛋白被萃取到离子液体中后,血红素分子的最大吸收波长发生改变,其最大吸收波长从406nm变为410nm,这表明在离子液体中血红蛋白的血红素分子结构发生了改变。图4-10(b)为血红蛋白浓度1.5mg/mL时的吸收光谱。从图可以看出,在水溶液中时,血红蛋白在538nm、574nm、630nm有明显的吸收,538nm为血红蛋白的Q带吸收峰,574nm和630nm为血红蛋白的特征吸收峰;然而当血红蛋白被萃取到离子液体中后,其Q带吸收峰从538nm变为530nm,其特征吸收峰从574nm变为556nm,同时630nm处的吸收峰消失。
从吸收光谱图可以看出,在萃取过程中血红素配位结构发生了改变。在水溶液中,血红蛋白的血红素中铁原子是二价亚铁原子,为五配位结构,铁原子第六个配位位置与水分子结合[29];而当血红蛋白被萃取到离子液体中后,铁原子第六个配位位置与咪唑阳离子结合形成配位键,从而导致其吸收光谱的明显变化。

图4-10 水相和离子液体相中两个浓度时血红蛋白的UV-Vis光谱
a—在水相 b—纯IL c—在IL相 d—在水相 e—纯IL f—在IL相(https://www.xing528.com)
4.3.6.4 荧光光谱
基于以上萃取机理,在萃取过程中咪唑阳离子与血红素中铁原子发生配位,这样必然会导致咪唑阳离子结构发生改变,因此,如果能够测定咪唑阳离子在萃取前后结构发生变化,则可以定性地判断咪唑阳离子在萃取过程中发生了配位。
实验中测定发现,离子液体在一定波长激发下,能够发射出明显的荧光。这部分内容将在第6章中详细讨论。BtmsimPF6是一种疏水性离子液体,其水中溶解度约为0.5g/L。实验中将离子液体与二次去离子水混合,强烈震荡使离子液体充分地溶解到水中。将饱和的离子液体的水溶液在344nm激发波长下激发,测定其荧光光谱,如图4-11所示。
当以344nm波长激发时,离子液体BtmsimPF6在421nm处有明显的荧光,当离子液体饱和水溶液中加入血红蛋白后,其荧光光谱的最大吸收波长发生明显的红移,从421nm转变为435nm,且荧光强度比纯离子液体水溶液的荧光强度明显降低(图4-11曲线b)。对比以上实验结果可以看出,在有血红蛋白时离子液体的咪唑阳离子结构发生改变。而这个变化主要是由于血红蛋白中血红素的铁原子与离子液体咪唑阳离子中的氮原子配位后,咪唑阳离子的电子云分布发生改变,因此,导致其荧光强度及最大发射波长发生改变。
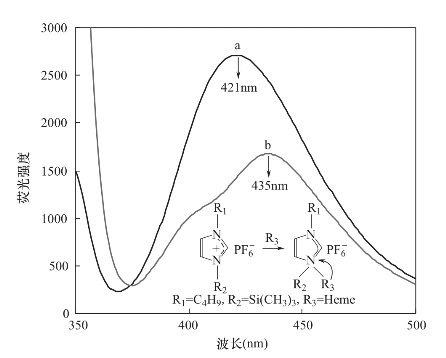
图4-11 BtmsimPF6的荧光光谱
a—离子液体饱和水溶液 b—血红蛋白浓度为100ng/μL的离子液体饱和水溶液
4.3.6.5 57Fe穆斯堡尔谱
由吸收光谱可确定在萃取过程中血红素分子结构发生改变,而由荧光光谱可推断出,在萃取过程中咪唑阳离子结构也发生改变,但并未确定配位原子。当与离子液体的咪唑阳离子配位后,铁原子的电子结构会发生相应的改变。为了证明血红素中的铁原子是否与离子液体咪唑阳离子发生配位,测定了血红蛋白的57Fe穆斯堡尔谱。
实验中测定了纯血红蛋白及血红蛋白与离子液体加合物的57Fe穆斯堡尔谱,如图4-12所示。从图中可以看出,在室温下测得的血红蛋白及血红蛋白与离子液体加合物的57Fe穆斯堡尔光谱图形均为单峰,这表明血红蛋白中铁原子在室温下是顺磁性的。根据获得的光谱进行数据计算,模拟得到血红蛋白及血红蛋白与离子液体加合物的57Fe穆斯堡尔谱相关参数。血红蛋白的同质异能移(IS)为0.2348,四极劈裂(QS)为0;而血红蛋白与离子液体加合物的同质异能移(IS)为0.2161,四极劈裂(QS)为-0.0545。从获得的相关参数可以看出,当血红蛋白与离子液体结合后,其同质异能移(IS)降低。同质异能移(IS)降低主要来自两个方面:一是铁原子外层s轨道电子云密度增大,另外一个是铁原子外层d轨道电子云密度降低[30,31]。通过分析认为,在本实验中血红素中铁原子的IS值降低主要是由于血红素中铁原子外层d轨道电子云密度降低引起的,按照上述萃取机理,咪唑阳离子带正电荷,是缺电子体系,当与血红素铁原子配位时,铁原子的外层d轨道与咪唑氮原子外层轨道杂化失去部分电子,从而导致铁原子的IS值降低。

图4-12 血红蛋白及离子液体与血红蛋白加合物的57Fe穆斯堡尔光谱
血红蛋白的铁原子四极劈裂(QS)为0,表明在血红蛋白中铁不存在超精细结构,而在血红蛋白与离子液体的结合物中,四极劈裂(QS)为-0.0545,这表明铁原子的电子云对称性发生改变。同时QS值为负,表明铁原子与离子液体咪唑阳离子的配位杂化轨道是垂直于血红素分子平面的[32-33]。
从血红蛋白的57Fe穆斯堡尔谱可以看出,在萃取过程中离子液体咪唑阳离子的氮原子与血红素中的铁原子发生配位,导致血红素中铁原子电子结构发生改变,且配位杂化轨道是垂直于血红素平面。
4.3.6.6 血红素中铁原子的第六空配位
基于获得的实验结果和机理讨论,可以推断出血红蛋白主要是通过血红素中铁原子与离子液体咪唑阳离子间的配位作用,而被萃取到离子液体中。细胞色素C是一种含有血红素分子的蛋白质,实验中也采用离子液体对细胞色素C进行萃取研究。结果表明,尽管细胞色素C中存在着血红素基团,但是细胞色素C在相同的实验条件下是不能被离子液体萃取的。
实验研究发现,当溶液的pH小于2时,离子液体BtmsimPF6能够萃取细胞色素C。通过测定血红蛋白与细胞色素C的圆二色光谱(CD)发现,在pH为1时,细胞色素C的光谱图与血红蛋白的光谱图形状相似,如图4-13所示。从CD光谱可以看出,当溶液的pH为7时,细胞色素C在406nm有一个正峰,在420nm处有一个负峰,这主要是由于细胞色素C中的血红素基团的铁原子除了与卟啉的四个氮相配位外,其第五、六配位分别与邻近的组氨酸-18和methionyl-80相配位[34];而当细胞色素C水溶液的pH小于2时,420nm处的负峰消失,406nm处的正峰强度增大。这表明细胞色素C的铁原子与methionyl-80的配位断裂,与血红蛋白的CD光谱状相似[图4-13(a)],因此,可以推测在pH小于2时,细胞色素C中铁的配位结构与血红蛋白中铁的配位结构是相似的。
通过以上分析,认为细胞色素C在pH为7时,铁原子以六配位结构形式存在,第六配位已与methionyl-80相配位,因此,无法与离子液体的咪唑阳离子结合,从而不能够被离子液体萃取;而当溶液的pH小于2时,第六配位断裂,当与咪唑阳离子接触时与之发生配位,从而将细胞色素C萃取到离子液体中。
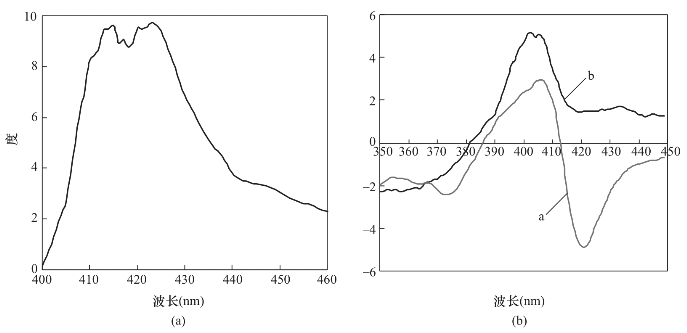
图4-13 血红蛋白与细胞色素C的CD光谱
(a)血红蛋白的CD光谱:血红蛋白浓度为250ng/μL。
(b)细胞色素C的CD光谱:细胞色素C浓度为200ng/μL。
a—pH为7 b—pH为1
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




