五、克隆体与干细胞培养
1.克隆羊及其他
1997年2月,英国科学家维穆特(I.Wilmut)在《Nature》上报道了体细胞克隆“多利羊”出生,一时惊动世人,这是怎么一回事呢?我们知道,哺乳动物体细胞经组织分化,已缺乏全能性。所以,在这个实验中,最重要的是要使已分化的细胞脱分化成为未分化的细胞。并找到与受体卵细胞能够相容的供体核。
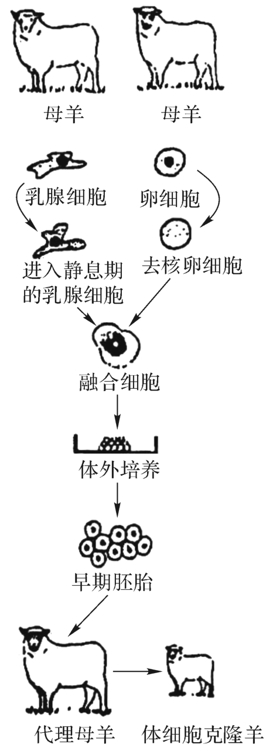
图4-25 体细胞克隆羊过程
这项实验的主要方法是:先取下成年羊处于G0期(静息期)的乳腺细胞使它的DNA复制与受体卵细胞同步,再以0.5%血清浓度培养5天,取其核作为供体细胞核;另将母绵羊去核卵细胞作为受体细胞。通过电脉冲使供体核和卵质融合成融合细胞。将此融合的新细胞先植入母羊的输卵管中6日,使其发育成胚胎,然后再植入代理母羊的子宫内,其中有一只怀孕成功,产下“多莉”子代(图4-25)。经DNA微卫星对4个多态性基因位点检测表明,“多莉羊”的电泳图谱与供核的绵羊相同,证明它是体细胞克隆羊。
Wilmut的工作意义首先证明了哺乳动物的体细胞可以回复到原始未分化状态,只有将供体细胞诱导至G0期,方可获得正常发育的全能性。然而要脱分化的体细胞核与移入的卵细胞融合并发育成胚胎,还必须重新启动这种体细胞基因表达程序。因此,体细胞克隆动物的研究必将对细胞遗传学、发育生物学产生深远的影响。自此以后,克隆(clone)之风骤起,英、美、法、中、韩等国家都开展了体细胞克隆猪牛羊等哺乳动物,克隆数量成批出现,如我国2002年就成功克隆了16头“同父异母”羊。
2.克隆人与克隆器官
体细胞羊的产生,有如孙悟空拔毫毛变成小孙悟空的复制。于是有新闻媒体调侃:“复制一个你,让你领回家。”这也引起了对克隆人的激烈讨论,大多数持忧虑和反对,克隆技术一旦用于人类自身,人类新成员的诞生,那是一种高科技的实验产品而不是父母爱情的结晶。这样的状况必将冲击人的尊严,必将扰乱社会的伦理道德观念。
但是,科学实验又无法绝对禁止,克隆人体器官作为医疗之需的研究正在开展起来,一种是借助动物,搞人体转基因的动物器官,一种是搞人体克隆胚胎。其中,猪的心脏、大小、特点与人的相近似,已被科学家看中,可作为人体基因的改造器官。有实验表明,载入人体的转植猪心脏排斥人类基因的几率很低。当然,这些克隆猪的心脏,移植于人类之前,都必须经过遗传改良,以尽量减少移植的危险。利用克隆技术有望产生专门化的医用猪,这种经过遗传改良的猪可望提供移植器官。其培育步骤是先将猪细胞中存在的能与人体产生免疫、排斥反应的基因进行修饰或除去(譬如猪器官在L-1,3半乳糖苷转移酶对人体组织免疫球蛋白认识表位上的差异引起急性免疫排斥,如果去掉这个酶基因或许就不会发生这种情况)。再将猪的某些控制遗传病的基因除去以避免器官移植时造成未知疾病的传播,然后通过将动物体细胞克隆技术与人的干细胞技术结合,就可以从猪体内获得理想的器官。这为人类的器官移植开辟了新途径。
3.胚胎干细胞与体外培养株
胚胎干细胞(embryonic stem cells,ESC)的研究,是近10多年来生命科学研究领域发展最受重视的生物技术。干细胞的“干”是英文单词“Stem”,意译为“起源”、“茎干”。它具有无限的自我更新能力,具有分化为一种以上高度分化的子细胞的能力。它实际包括了从胚胎发育到成人生长发育过程中各种未分成熟的细胞。存在于生命体不同发育阶段的干细胞,其自我更新和分化潜能有明显差别,如神经干细胞、造血干细胞、表皮干细胞等。胚胎发育源于受精卵,它可以发育成完整个体。所以,受精卵是一种最原始和分化潜能最大的干细胞,但尚未发现有明显更新能力,因此把它称之为全能细胞(totipotent stem cells)。
胚胎生殖细胞(EG)是早期胚胎生殖嵴中原始生殖细胞(primordialgerm cells.PGC)经体外培养获得的干细胞,具有体外分化多能性类似于胚胎干细胞特点,并能形成嵌合体。因此,ES和EG细胞具有经培养不定期地分化并产生特化细胞的能力,具有以下几点:①有多向分化潜能和受精卵的某些特性,可以分为胎儿和成体内各类型的组织细胞;②可在体外培养条件下建立稳定的细胞体系,可长期增殖培养;③将ES细胞与8~16细胞(桑葚胚)阶段的胚卵共培养后,植入假孕母体子宫,可发育成嵌合动物,其遗传特性可进入胚系遗传给下一代。所以,体外ES细胞和EG细胞培养的最大特点可以对它进行遗传改造、核转移和冷冻等而不失去潜能性。
由于人类发育从一个受精卵发展成具有200多种细胞所构成的组织和器官,是靠多能性的内细胞(inner cellmass,ICM)不断增殖与分化来实现的。人胚胎干细胞(human embryonic stem cell,hESC)培养是从囊胚期分离,并在体外建系的细胞。1998年,美国威斯康大学Thomson实验室利用36枚临床治疗不孕夫妇捐赠的新鲜的或冷冻的囊胚,首次成功地分离,建立了5株hES细胞系。与此同时,结合体细胞核转移技术用于hESC系建立使这项技术有着更大的可用性。这幅由Solter和Gearhart(1999)提出的图解(图4-26)已成为人胚胎干细胞培养的经典性资料。近几年,各国科学家也相继成功地培养hES细胞在体外生长,增殖成功,其中包括美国、英国、新加坡、澳大利亚、瑞典、西班牙、日本、韩国和中国等10余个实验室建有约120株hES细胞。中国胚胎干细胞研究始于2000年,已知有5例人受精卵的囊胚建成了3个hES细胞株(王彦,2005)。
4.胚胎干细胞培养与应用
人胚胎干细胞医学治疗研究,一般采用与高等动物相结合地进行试验。例如,日本科学家在世界上首次用猴胚胎干细胞生成两种末梢神经,随之,将这种神经干细胞再植入6只患有帕金森氏症的猴子的脑部,结果它们的病“情”明显好转,又各利用实验鼠皮肤细胞制成可分化为各种组织和器官的“多能细胞”,这为利用人类皮肤细胞“仿制”胚胎干细胞打下了技术基础。报2007年报道,美国科学家用不同猕猴皮肤细胞和卵子培育出胚胎细胞,又将人体皮肤细胞改造成了几乎能和胚胎干细胞相媲美的干细胞。这一成果有望使胚胎干细胞研究避开伦理争议,从而大大推动与干细胞有关的疾病治疗研究。
关于干细胞的人类疾病治疗方面的应用,已在以下几方面得到重视。在一定条件下,ES经过培养分离可定向诱导分成皮、骨骼细胞、肌肉细胞、血液细胞和神经细胞等,有望为各种疾病提供一种有效的根治手段。
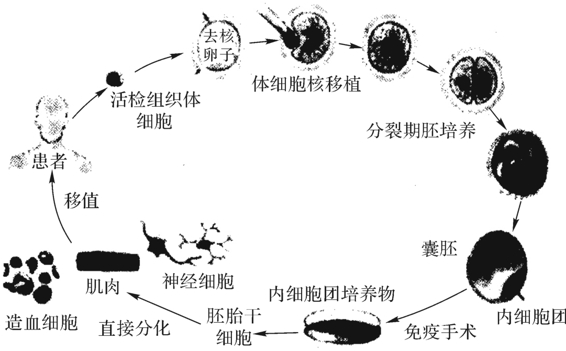
图4-26 体细胞核转移技术用于人ESC系建立的技术路线
(Solter and Gearhart,1999)
(1)血液系统疾病治疗
体外定向诱导可使ES细胞生成造血干细胞,进一步在体外则生成各种血细胞、干细胞和B细胞。这提示ESC可作用造血干细胞的来源,用于白血病、再生障碍性贫血的造血功能重建及免疫缺陷疾病的免疫重建。我国现已掌握了脐血干细胞分离、强化、冷冻保存以及复苏的一套技术,并在上海、北京开始筹建大型的脐血库为患者提供脐带血干细胞(做移植用)。
(2)神经干细胞治疗
神经干细胞中枢神经系统中保持分裂和潜能的细胞。目前美国有几家神经干细胞研究公司从胎儿组织中分离出神经干细胞,初步表达出把神经干细胞注入小鼠大脑,细胞将迁移到损伤部位,分化成所需的细胞种类。神经细胞的移植特点不具有免疫排斥反应。如给帕金森氏综合症的患者脑内移植含有多巴胺生成细胞的人胚胎脑组织,可以治愈部分患者的症状。但此方法没有广泛采用的主要原因是胎儿脑组织很难取材。尽管在体外可以分离和培养神经干细胞,但目前对神经干细胞的生物学特性知之甚少,而许多诱导的关键性技术尚未解决。
(3)组织器官移植治疗
通过控制ES细胞生长环境转染某一种系细胞形成决定基因或利用某种系特定启动子控制的抗药性基因富集转基因ES细胞,可获得特定种系的较纯化的细胞,将这些细胞用于移植治疗,能缓解组织操作造成的帕金森病、糖尿病、脊髓损伤、造血系统疾病等多种疾病。例如,Brustle等将ES细胞体外生成的小突神经胶质细胞前体移植到人类脊髓疾病的大鼠模型后,这些细胞与宿主神经元相互作用,充分髓鞘化形成了脑和脊髓中的轴索。又如从胰腺组织中分离了胰腺干细胞,在体外进行了培养,结果发现有30%的胰腺干细胞可以变成分泌胰岛素的细胞。当这些细胞移植鼠的体内,不仅存活了,而且还在继续分泌胰岛素。最近研究还表明胚胎干细胞和胰腺干细胞可定向诱导分化为胰岛β细胞,为糖尿病患者带来了新的希望,也为研究者提供了治疗糖尿病的新突破。
(4)骨髓干细胞的功能
骨髓是人体的干细胞库,其中干细胞含量丰富,可以直接穿刺采集,建立多种体外分离技术,操作简便,且不存在免疫排斥问题,因此受到人们的关注。在人体干细胞研究早期就发现,直接把骨髓造血干细胞注射到脑组织中可以转变为神经细胞。把神经干细胞移植到骨髓也能生成各种血液细胞,这就是通常所说的横向分化概念。骨髓干细胞是一个混合群体,至少包括造血细胞、间充质干细胞、内皮前体细胞。研究者认为脑组织中分泌的成纤维细胞生长因子能促进骨髓间充质干细胞的增殖,分泌的神经营养因子能作用于骨髓间充质干细胞的神经生长因子的受体,从而促进向神经细胞分化。
参考文献(https://www.xing528.com)
1.陈阅增等.普通生物学.北京:高等教育出版社,1997
2.Watson JD,Crick FCH.Molecular Structure of nucleic acid:Astructure for deoxyribose nucleic acid.Nature,1953,171:737—738
3.Stryer L.Biochemistry(3th Ed).New York:W.H.Freeman and Co.,1998
4.沃森JD等.重组DNA简明教程.沈孝亩译.北京:科学出版社,1987
5.摩尔根TH.基因论.卢惠霖译.北京:科学出版社,1959
6.吴乃虎.基因工程原理(上册).北京:科学出版社,1997
7.米克勒斯DA等.DNA科学导论.陈永清等译.北京:科学出版,2005
8.朱玉贤,李毅.现代分子生物学.北京:高等教育出版社,1999
9.李振刚.分子遗传学.北京:科学出版社,2000
10.李明刚.高级分子遗传学.北京:科学出版社,2004
11.孙汶生等.基因工程学.北京:科学出版社,2004
12.刘祥林,聂刘旺.基因工程.北京:科学出版社,2005
13.吴建平.简明基因工程与应用.北京:科学出版社,2005
14.贺淹才.简明基因工程学原理(第二版).北京:科学出版社,2005
15.李元.基因工程药物.北京:化学工业出版社,2002
16.阎新甫.转基因植物.北京:科学出版社,2003
17.陈永福.转基因动物.北京:科学出版社,2001
18.叶兴国等.主要农作物转基因研究现状和展望.中国生物工程杂志,2006,16(5):93—100
19.邓洪新等.基因治疗的发展、问题与展望.生命科学,2005,17(3):196—199
20.Pearson S,et al.China approves first gene therapy.Nat Biotechnol,2004,22(1):3—4
21.朱作言等.转基因鱼模型的建立.中国科学(B辑),1999,2:147—155
22.王伟等.鱼类生长激素基因工程研究.自然科学进展,2002,12(5):456—460
23.Marc Wel T,梁利群等.鲫鱼HindⅢ高重复DNA序列的分子克降(英文).动物学报,2004,5:
24.王小珂,沈孝宙等.转基因禽蛋——新一代基因工程生物反应器.中国生物工程杂志,2003,23(3):35—38
25.裴雪涛.干细胞生物学.北京:科学出版社,2003
26.Gearhart J.New potential for human embryonic stem cells.Science,1998,282:1061—1062
27.Thomson JA,et al.embryonic Stem Cell lines drived from human blastocysts.Science,1998,282,1145—1147
28.Wilmut L,et al.Viable offspring derived from fetal and adultmammalian cells.Nature,1997,385:810
29.王彦等.人胚胎干细胞培养建系及其应用,细胞生物学杂志,2005,27:374—378
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




