1.定律内容
法拉第归纳了多次试验的结果,于1833年总结出了一条基本规律,称为法拉第定律:电解质溶液通电之后,在电极上发生化学变化的物质的物质的量与通入的电量成正比;若将几个电解池串联,通入一定的电量后,在各个电解池的电极上发生反应的物质的物质的量等同,析出物质的质量与其摩尔质量成正比。
1mol质子的电荷(即1mol电子所带电量的绝对值)称为法拉第常数,用F表示,其值为
式中 L——阿伏伽德罗常数;
e——质子的电荷。
工程中,F可取26.8A·h或1608A·min。
如欲从含有Mz+的溶液中沉积1mol金属M,即
则需要通过1mol×z+个电子,z+是出现在电极反应式中的电子计量系数。因此,当通过的电量为Q时,沉积出的该金属的物质的量(n)为
或一般写作
所沉积的金属的质量为
式中 M——析出物的摩尔质量,其值随所取的基本单元而定;
Q——总电量(即电流I与通电时间t的乘积)。
式(1-60)和式(1-61)是法拉第定律的数学表达式,它概括了上述法拉第定律的两条文字表述。式(1-61)表示在电极上析出(或溶解)的物质的质量m与通过电解质溶液的总电量Q成正比,即
其中比例系数K的值与所析出(或溶解)的物质有关,称为该物质的电化学当量(简称电化当量)。电化当量等于通过1C电量时析出(或溶解)物质的质量。电化当量的倒数
称为理论耗电量,即生成单位质量物质所需的电量。
【例】 将0.025A(C·s-1)的电流通过硝酸金[Au(NO3)3]溶液,当阴极上有1.20 g Au(s)析出时,试计算:(1)通过了多少电量?(2)需通电多长时间?(3)阳极上将放出多少氧气(换算成标准状态,用体积表示)?已知Au(s)的摩尔质量为197.0g·mol-1。
解:电极反应写为(https://www.xing528.com)
阴极 Au3++3e-→Au(s)
阳极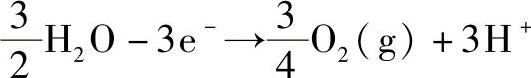
出现在电极反应式中的电子计量系数z=3,所取的粒子基本单元为Au和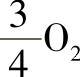 。
。
(1)通入的电量为
(2)通电时间为
(3)两极上通过的电量Q相同,所以阳极上放出氧气的物质的量为
在标准状态时,O2的体积为
法拉第定律在任何温度和压力下均适用,没有使用的限制条件。而且试验越精确,所得结果与法拉第定律吻合越好,此类定律在科学上并不多见。
2.电流效率
在实际电解时,电极上常发生副反应或次级反应。例如镀锌时,在阴极上除了进行锌离子的还原反应以外,同时还可能发生氢离子还原的副反应。又例如电解食盐溶液时,在阳极上所生成的氯气,有一部分溶解在溶液中发生次级反应而生成次氯酸盐和氯酸盐。因此要析出一定数量的某一物质时,实际上所消耗的电量要比按照法拉第定律计算的理论电量多。此两者之比称为电流效率,通常用百分数来表示。当析出一定数量的某物质时,电流效率为
或者当通过一定电量后,其为
【例】 需在10cm×10cm的薄铜片两面镀上0.005cm厚的Ni层[镀液用Ni(NO3)2],假定镀层能均匀分布,用2.0A的电流得到上述厚度的Ni层时需通电多长时间?[设镀层密度为8.9g·cm-3,Ni(s)的摩尔质量为58.69g·mol-1,电流效率为96%。]
解:电镀层中含Ni的物质的量为
电极反应为
Ni2++2e-→Ni(s)
则
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




