(一)酶的活性中心
酶分子多肽链的侧链中存在着许多化学基团,如氨基、羧基、羟基、咪唑基、巯基等,这些基团不一定都与酶活性有关。酶分子中只有那些与酶活性有关的基团,被称作酶的必需基团(essential group)。常见的必需基团有丝氨酸残基的羟基、组氨酸残基的咪唑基、半胱氨酸残基的巯基、酸性氨基酸残基的羧基(表3-2)等。这些基团多具有独对电子,易与底物形成配位键。酶蛋白分子中能与底物特异结合并发挥催化作用,将底物转变为产物的具有特定三维结构的区域称为酶的活性中心(active center)或活性部位(active site)。
表3-2 一些酶活性中心的必需基团


图3-1 酶的活性中心
酶活性中心(图3-1)内的必需基团有两种:一种是结合基团(binding group),其作用是识别底物并与之特异结合,使底物与具有一定构象的酶形成酶-底物过渡态复合物;另一种是催化基团(catalytic group),其作用是影响底物中的某些化学键的稳定性,催化底物发生化学反应,从而将其转变成产物。有些酶的必需基团同时兼有结合和催化两种功能。已知,构成酶活性中心的氨基酸残基只是一小部分,常常只占整个酶分子体积的1%~2%。酶分子的催化部位常常只由2~3个氨基酸残基构成。而酶分子中大部分氨基酸残基作为支架用于形成酶分子的三维空间结构。
除了酶活性中心内的必需基团之外,酶在活性中心以外也有必需基团。它们虽然不直接参与催化作用,但却是维持酶的特殊的空间构象所必需的,称为酶活性中心外的必需基团。如果酶的这些必需基团被修饰,酶的空间结构会出现较大的改变,从而影响酶活性中心的形成及酶的催化作用。
酶活性中心是由一级结构上可能相距较远,但在三维空间结构上却十分接近的几个氨基酸残基形成的具有一定空间结构的区域。酶活性中心常常是具有三维空间结构的裂缝或裂隙(crevice)。此裂缝多为氨基酸残基的疏水基团形成的疏水“口袋”,深入到酶分子内部,形成一个易与底物结合的环境,利于催化作用的发生。在此裂隙中底物浓度可达很高。
图3-2显示了溶菌酶的活性中心,该部位能容纳一个六糖分子(NAG)6,A、B、C、D、E、F表示6个糖残基的位置。第四个糖残基D环由于空间限制作用由正常的椅式结构变成能量较高的半椅式构象,导致D~E之间的糖苷键稳定性降低,容易断裂。酶分子的Glu35和Asp52催化D环的糖苷键断裂,使E、F二聚体与A、B、C、D四聚体分开。
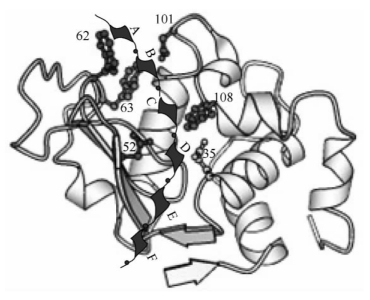
图3-2 溶菌酶的活性中心(https://www.xing528.com)
溶菌酶与其底物(NAG)6的6个N-乙酰氨基葡糖环(A、B、C、D、E、F)形成E-S复合物,Glu35和Asp52为该酶的催化基团,催化D环的糖苷键断裂。Asp101、Trp108是该酶的结合基团
(二)同工酶
同工酶(isoenzyme)是指催化相同的化学反应,但酶分子结构、理化性质及免疫学性质等不同的一组酶。同工酶是由不同基因编码的多肽链或由同一基因转录生成的不同mRNA翻译生成的不同多肽链组成的蛋白质。同工酶可存在于同一种属或同一个体的不同组织中,也可存在于同一个体的同一组织、细胞的不同亚细胞结构中。在个体发育的不同阶段,同一组织也可因基因表达的不同而有不同的同工酶谱。
哺乳类动物细胞的乳酸脱氢酶(lactate dehydrogenase,LDH)共有5种同工酶。该酶是由两种亚基构成的四聚体,一种亚基是骨骼肌型(M),另一种亚基是心肌型(H)。这两种亚基以不同比例组成5种同工酶(图3-3)。由于5种同工酶结构上的差异,使各种同工酶的电泳行为及对底物的Km有显著不同,5种LDH的电泳速率由1型向5型递减。
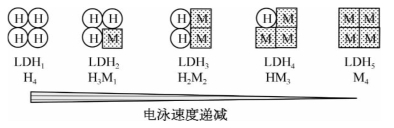
图3-3 LDH同工酶
LDH同工酶在不同组织中含量和分布比例不同,各组织器官有各自特定的分布酶谱,因此使不同组织细胞有不同的代谢特点。例如,骨骼肌富含LDH5,其对NAD+亲和力较低,对NADH和丙酮酸亲和力强,催化丙酮酸还原成乳酸,保证肌肉组织在短暂缺氧时仍能快速获得能量;而心肌富含LDH1,易使乳酸变成丙酮酸而被利用。可见LDH1和LDH5虽然催化同一反应但催化方向不同,对不同组织器官起着重要调节作用。研究指出,在生物体的不同发育期的同工酶种类可不同。如在鼠出生前5天时心肌以LDH4为主,而生后12天主要含LDH2和LDH3。肌酸激酶(creatine kinase,CK)是二聚体,其亚基有M型(肌型)和B型(脑型)2种,共有3种同工酶。脑中含CK1型(BB型);骨骼肌含CK3型(MM型),心肌含CK2型(MB型)。在电泳中向正极泳动的速率从快到慢依次为CK1、CK2、CK3。
同工酶的测定对于疾病的诊断及预后判定有重要意义。当组织细胞病变时,某种同工酶即释放入血浆。血浆同工酶总活性及同工酶谱的分析有助于疾病的诊断及预后的判断。如心肌梗死后3~6小时血中CK2活性升高,24小时酶活性到达顶峰,3天内恢复到正常水平。CK2主要存在于心肌组织中,其他组织和器官含量很少,所以CK2是诊断心肌梗死的一个极其可靠的生化指标。LDH释放入血比CK2迟1~2天,发病后24~48小时后逐渐升高,3~6天达到顶峰,8~14天才恢复正常。正常血浆LDH2活性高于LDH1,心肌梗死可见LDH1高于LDH2。此外,急性肝炎时LDH5明显升高,肝硬化时LDH1、LDH3和LDH5都升高。原发性肝癌时LDH3、LDH4和LDH5升高,并且LDH5高于LDH4。转移性肝癌时LDH3、LDH4和LDH5升高,但LDH4高于LDH5。
(三)酶的一级结构、空间结构与酶的活性
酶的一级结构是酶发挥催化功能的结构基础。酶的一级结构改变可能使其催化功能发生一定的改变。与酶活性密切相关的氨基酸序列是维持酶活性的关键。有相同催化功能的同一类酶,其活性中心的一些氨基酸序列有极大的同源性。如胰蛋白酶(trypsin)、胰凝乳蛋白酶(chymotrypsin)和弹性蛋白酶(elastase)均属于丝氨酸蛋白酶家族,这三种酶活性中心的氨基酸残基有25%的同源性,甚至二硫键的位置亦相同。它们的活性中心均含有丝氨酸和组氨酸残基,而木瓜蛋白酶、菠萝蛋白酶的活性中心则含有半胱氨酸和组氨酸残基。
酶的催化活性除了依赖于酶的一级结构,也与它的正确的空间构象密切相关。如上述三种丝氨酸蛋白酶的活性中心丝氨酸残基附近都有一个立体的“口袋”状结构,被水解肽键羧基侧的氨基酸侧链恰好落在这个口袋中。胰蛋白酶的口袋较深,底部含带负电的Asp189,可容纳底物的带正电荷的长侧链精氨酸或赖氨酸,使精氨酸或赖氨酸的羧基端肽键被水解。胰凝乳蛋白酶的口袋较宽,并由非极性氨基酸残基构成,故可容纳侧链大的疏水性氨基酸和芳香族氨基酸,使其羧基端肽键被水解。弹性蛋白酶的袋口两侧均为缬氨酸,对侧链大或长的残基的进入有阻碍作用,故该酶易水解侧链小的非极性氨基酸的羧基端肽键。一些酶具有四级结构,四级结构完整时,酶的催化功能才可正常发挥。因此酶的特异的三维空间结构是酶催化功能的基础。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




