1.电镀铝
第1代离子液体为氯铝酸型,虽然可用于电镀铝,但此类离子液体对水非常敏感,并且质子和氧化物杂质的存在对离子液体的化学性质影响显著,因此要在真空或惰性气体气氛保护下进行,从而限制了其广泛应用。第2代离子液体以[EMIm]BF4为典型代表,其对水和空气稳定,但遇水容易放出少量HF,并且遇到AlCl3时也会释放出HF。第3代离子液体称为“任务专一型”离子液体,通过改变阳离子结构可调整离子液体的性质。
采用[EMIm]Cl-AlCl3(摩尔比为1∶2)离子液体电解质,以铜、钨或铝为阴极,电镀可得到致密、连续、附着牢固的铝镀层。
由于[EMIm]Cl具有很强的吸水性,因此电解液的配制过程需在充满氩气保护的手套箱中进行。具体过程如下:首先称量一定质量的[EMIm]Cl于干燥烧杯中,将其置于恒温加热磁力搅拌器上,加热至其完全熔化;然后按比例称量无水AlCl3,将其缓慢分批加入熔化后的[EMIm]Cl中,溶解过程有少量白烟产生,磁力搅拌直至无水AlCl3完全溶解,最终获得浅黄色透明状的离子液体电解液。
电镀铝的工艺条件为:阴极电流密度2.0~2.5A/dm2,温度50~55℃,添加剂5mL/L。所得铝镀层表面有许多大小较均一的胞状颗粒,结晶致密,分布均匀。铝镀层为面心立方结构,平均晶粒尺寸约为55nm。铝镀层在空气中易氧化,镀层表面铝的质量分数为84.12%,氧的质量分数为15.88%。
2.电镀镁
工艺1:在含0.25mol/LMg(AlCl2BuEt)2/THF(其中Bu表示丁基,Et表示乙基,下同)离子液体中,以铜为基体,在电流密度0.05A/cm2下可电镀得到金属镁。
工艺2:在[PMP](CF3SO2)N[1-丙基-1-甲基吡咯鎓双(三氟甲基磺酰基)亚胺盐]和Mg(CF3SO3)2(三氟甲磺酸镁)体系中电镀镁,得到的镀层光滑性、致密性不是很好。
工艺3:在含有0.3mol/LMg(CF3SO3)2的[BMIm]BF4离子液体电解液中,加入质量分数为5%的碳酸丙烯酯后,可使电镀镁与镁的阳极溶解可逆进行,循环次数可达200次以上。
工艺4:在[BMP]Tf2N[1-丁基-1-甲基吡咯鎓双(三氟甲磺酰基)亚胺盐]、[EMIm]BF4(1-乙基-3-甲基咪唑四氟硼酸盐)和[BMP]TfO(1-丁基-1-甲基吡咯鎓三氟甲磺酸盐)离子液体中电镀镁。结果表明,加入格氏试剂可提高电镀镁时的阴极电流效率。
3.电镀铜
关于离子液体中电镀铜,主要是研究了[BMIm][TfO]离子液体中的电镀。
图8-4所示为20mmol/LCuCl2的[BMIm][TfO]离子液体电解液中在不同电极上的循环伏安曲线,测试温度为70℃,扫描速度为50mV/s。由图8-4可见,3个电极上的循环伏安曲线非常相似,这里以铂电极为例进行分析。如图8-4b所示,当从开路电势(0.07V)开始向负扫描时,电流开始慢慢上升,在-0.13V左右达到第1个峰值(C1);当电势扫到-1.0V时,出现了1个小峰(C2);到-1.3V左右时出了1个尖峰(C3);随后电流在下降时又出了两个小峰(C4和C5)。当电势从-2.0V处回扫时,电流又开始上升,形成了一个还原峰(C∗),这是由成核过程导致的;随后依次出现了A4、A3、A2和A1氧化峰。很明显,还原峰C1与氧化峰A1对应,这对氧化还原峰是由氧化还原电对Cu2+/Cu+引起的。还原峰C2峰值很小,可能是由于铜在铂表面的欠电势沉积引起的,在玻碳和钼电极上
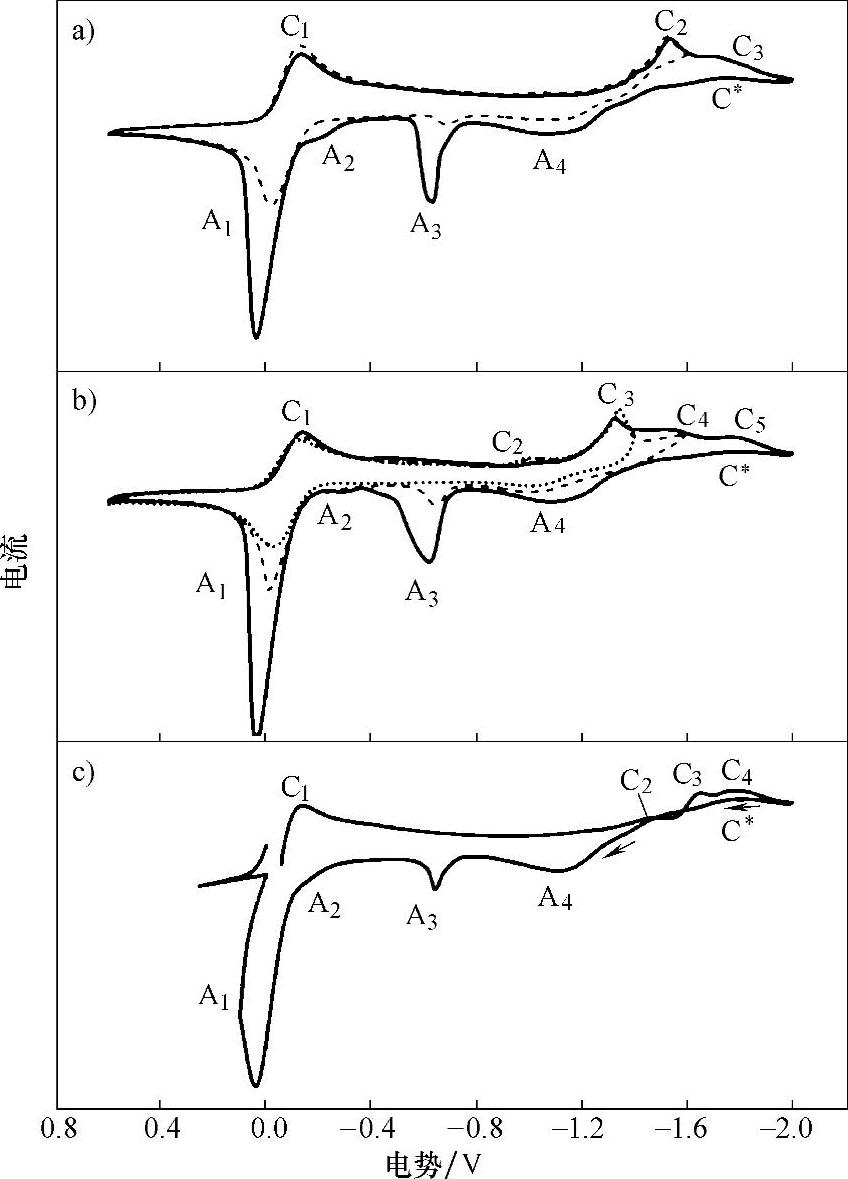
图8-4 20mmol/LCuCl2的[BMIm][TfO]离子液体电解液中在不同电极上的循环伏安曲线
a)玻碳电极 b)铂电极 c)钼电极
并未观察到这一还原峰。当电势在-1.6V处回扫时,氧化峰A4、A3、A2和A1峰高和峰面积都明显变小;当电势在-1.4V处回扫时,氧化峰A4和A1变得更小,但是观察不到氧化峰A3和A2。由此可以推测,还原峰C3对应铜的体相沉积,并且与氧化峰A4对应,即这对氧化还原峰对应着反应Cu+→Cu。还原峰C4和C5也应该对应着铜的体相沉积,这可能是由于Cu2+与溶液里的阴离子(Cl-和TfO-)形成的多种配合物的放电造成的。
在[BMIm][TfO]离子液体电解液中,以ITO/Mo为基体,在-1.7V、70℃下电镀0.5h得到的铜镀层的X射线衍射测试表明,在2θ角为43.30°和50.43°处出现的衍射峰与铜的标准谱图相对应,这说明得到了金属铜镀层。利用43.30°处的衍射峰的半峰宽,由Scherrer公式计算得到铜镀层的晶粒尺寸约为25nm。
4.电镀钴
关于离子液体中电镀钴,目前主要是在酸性[EMIm]Cl离子液体中的电镀。但是,酸性[EMIm]Cl电解液中由于AlCl3或ZnCl2的加入,其电解液体系极易吸水,须在惰性气体保护下的真空手套箱中进行操作。此外,金属钴镀层的纯度对于磁记录介质是极其重要的,必须通过控制电镀条件才可得到高纯度的金属钴。因此,欲得到纯的金属钴镀层,就不能在电解液中加入其他金属盐类。为此,需要采用疏水、疏氧型离子液体来电镀钴。
在[BMIm]BF4-Co(BF4)2电解液体系中,在温度60℃、电流密度0.8A/dm2下电镀5min,在铜基体上得到了银灰色、有金属光泽、均匀性和结合力均较好的金属钴镀层。由此可见,在[BMIm]BF4-Co(BF4)2电解液体系中得到的金属钴镀层质量较好。
在电解液温度为30℃,沉积电势为-1.6V,沉积时间为5min的条件下,电解液中Co2+浓度对金属钴镀层外观的影响见表8-2。
表8-2 电解液中Co2+浓度对金属钴镀层外观的影响

从表8-2可以看出,随着电解液中Co2+浓度的增大,所得金属钴镀层外观逐渐变好。当Co2+浓度小于0.25mol/L时,金属钴镀层呈褐色,外观均匀性和金属光泽均较差;当Co2+浓度在0.5~1.5mol/L区间内变化时,金属钴镀层均呈银白色,外观均匀性和金属光泽性较好。实验结果发现,当Co2+浓度大于2.0mol/L时,金属钴镀层外观变差。这是由于Co(BF4)2的浓度超出其在离子液体中的溶解度,导致电解液中金属盐的析出,从而影响镀层质量。
不同Co2+浓度的电解液中电镀得到的金属钴镀层的扫描电镜照片如图8-5所示。从图8-5a可以看出,当电解液中Co2+浓度为0.5mol/L时,金属钴镀层的晶粒较细小,但结晶较疏松;从图8-5b可以看出,当电解液中Co2+浓度为1.5mol/L时,金属钴镀层的晶粒较粗大,但结晶较致密;当Co2+浓度超过2.0mol/L时,金属钴镀层结晶粗糙,且金属钴镀层质量较差。这是由于随着电解液中Co2+浓度的增加,电镀初期在阴极表面上形成较多的生长中心,进而晶体生长表面增大,且较致密。但是溶液中Co2+浓度太高,溶液电阻增大,沉积电流密度随之降低,部分晶体开始钝化,只有其中一部分晶体能继续生长,得到的金属钴镀层外观比较粗糙。因此,在[BMIm]BF4离子液体电解液中电镀钴时,电解液中Co2+浓度为0.5~1.5mol/L较好。

图8-5 不同Co2+浓度下所得金属钴镀层的扫描电镜照片
a)0.5mol/L b)1.5mol/L
在电解液温度为60℃,Co2+浓度为1.0mol/L,电镀时间为5min的条件下,沉积电势对金属钴镀层外观的影响见表8-3。从表8-3可以看出,当沉积电势小于-1.10V时,得到的金属钴镀层呈灰褐色,外观不均匀且金属光泽较差;当沉积电势为-1.20~-1.80V时,金属钴镀层呈银白色,外观光泽性、均匀性和结合力均较好;但当沉积电势过大时,金属钴镀层外观质量变差,且镀液颜色变为棕褐色且有异味产生,这是由于离子液体中的BMIm+发生还原反应造成的。
表8-3 沉积电势对钴镀层外观的影响

不同沉积电势下电镀得到的金属钴镀层的扫描电镜照片如图8-6所示。从图8-6可以看出,当沉积电势为-1.20V时,金属钴的晶粒较细小,结晶较致密;当沉积电势为-1.80V时,金属钴的结晶变粗大、较疏松。这是由于沉积电势较低时,电流密度过高,阴极附近金属离子快速放电,结晶快速增长,造成沉积膜结晶疏松;在更低的沉积电势下,镀液稳定性下降,易分解,使金属钴镀层表面粗糙。因此,在[BMIm]BF4离子液体中电镀钴时,沉积电势为-1.20~-1.80V较好。

图8-6 不同沉积电势下得到的金属钴镀层的扫描电镜照片
a)-1.20V b)-1.80V
在沉积电势为-1.4V,Co2+浓度为1.0mol/L,电镀时间为5min的条件下,电解液温度对金属钴镀层外观的影响见表8-4。可以看出,当电解液温度为30~60℃时,所得到的金属钴镀层呈银白色,外观均匀性、金属光泽性和结合力均较好。当电解液温度升高至70℃,金属钴镀层颜色变为银灰色,且金属光泽性略差;另外,电解液颜色由粉红色变为紫红色,且电解池底部出现沉淀,这是由于钴盐在高温下易分解造成的。(https://www.xing528.com)
表8-4 电解液温度对金属钴镀层外观的影响
不同温度下得到的金属钴镀层的扫描电镜照片如图8-7所示。由图8-7可见,温度对所得金属钴镀层晶粒大小和致密性的影响较为明显。当温度为40℃时,金属钴镀层的晶粒较细小,结晶均匀但较疏松;当温度为60℃时,金属钴镀层的晶粒较粗大,结晶较均匀,且致密度有所提升。这是因为当温度较低时,电解液的黏度较大,金属离子的扩散速度较慢,因而在阴极附近的放电金属离子较少,晶核的形成速度较慢,所以结晶较疏松。随着温度的升高,电解液的黏度降低,金属离子的扩散速度加快,也使晶核形成速度增大,形成的晶粒就比较致密,且金属钴镀层的晶粒较大。但是温度过高时,会降低阴极极化,增大阴极沉积速度,促使结晶较差的金属钴镀层的出现。因此,电解液温度不易过高。在[BMIm]BF4离子液体中电镀钴时,电解液温度为30~60℃较好。

图8-7 不同温度下得到的金属钴镀层的扫描电镜照片
a)40℃ b)60℃
在Co(BF4)2浓度为0.5mol/L,沉积电势为-1.4V,电镀时间为2h的条件下,电解液温度对阴极电流效率的影响如图8-8所示。由图8-8可以看出,随着温度的升高,阴极电流效率呈先升高后降低的趋势。当温度为60℃时,电流效率最高,继续升高温度时,电流效率开始迅速下降。这是因为随着温度的升高,离子液体电解液的黏度降低,电导率增大,从而提高电流密度,有利于提高阴极电流效率;当温度过高时,Co(BF4)2在离子液体中分解,并开始形成沉淀,致使其阴极电流效率下降。
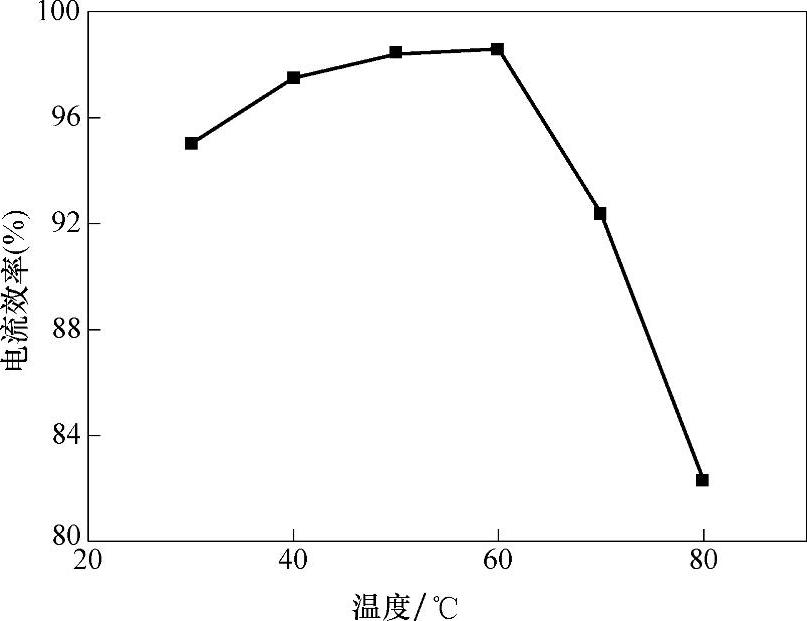
图8-8 电解液温度对阴极电流效率的影响
以[BMIm]BF4-Co(BF4)2为电解液体系,在Co(BF4)2浓度为1.0mol/L,沉积电势为-1.4V,电镀时间为3h的条件下,电解液温度对金属钴镀层晶体结构的影响见图8-9。将钴镀层的X射线衍射(XRD)图谱与金属钴的ASTM标准衍射卡片相对照,发现与标准卡片相一致。从图8-9可以看出,钴镀层的XRD图谱中显示了金属钴的特征衍射峰,所有的衍射峰的位置及三强峰都与钴的ASTM标准卡相对应,即为密排六方结构(hcp)。XRD图谱分析表明,温度能够使金属钴的结晶发生明显的择优取向。当温度为40℃和70℃时,XRD图谱形状相似,3个主要的衍射峰(100)、(002)、(101)越来越宽,并且3个衍射峰也逐渐地连在一起,体现出微晶态的特征,说明沉积的钴是晶态和微晶态的混合物。但当温度为60℃时,晶面指数为(002)的衍射峰消失,衍射峰(100)强度最强,出现了明显的择优取向。
5.电镀锌
锌在钢铁的防腐蚀方面有着重要的作用。但是,为探讨电镀锌的特殊用途,人们开展了离子液体电镀锌的研究。
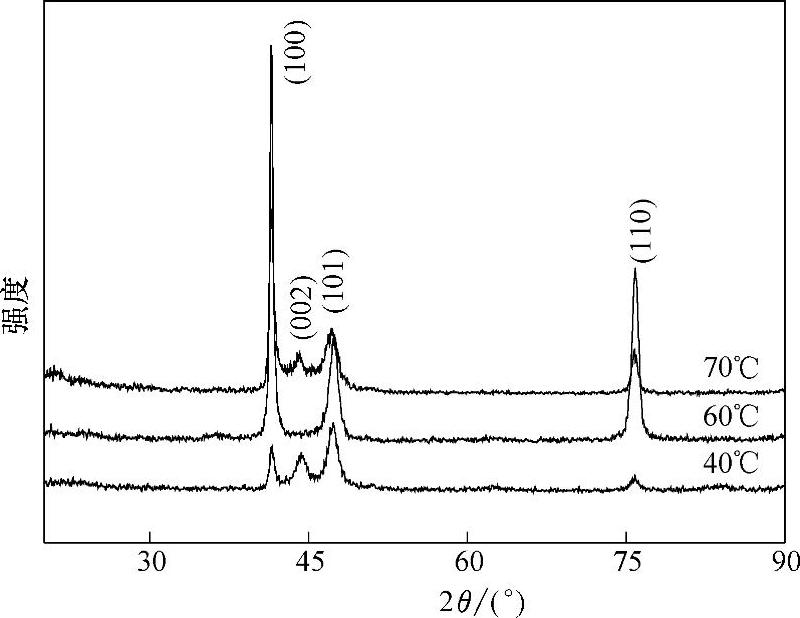
图8-9 电解液温度对金属钴镀层晶体结构的影响
工艺1:在离子液体[EMIm]Br-ZnBr2中,以Cu板为阴极,Zn板为阳极,并在氩气保护下进行电镀锌。实验结果表明:在此电解液中电镀锌时,当水的质量浓度<10×10-6g/L时,镀层有金属光泽,且表面光滑;当乙二醇(EG)的摩尔分数达到45%时,电镀过程的超电势消失。在电解液组分[EMIm]Br、ZnBr2和EG三者比例适当时,可获得光滑、具有银白色的金属光泽的锌镀层。
工艺2:在[EMIm]Br、ZnBr2质量分数分别为70%和30%的电解液中电镀锌时,当电流密度<1A/dm2时,可得到银白色、平整的锌镀层;当电流密度>1.5A/dm2时,可得到灰白色,但比较平整的锌镀层。在熔盐中添加乙二醇的质量分数为30%~75%时,能够获得光亮的锌镀层,并且电流效率达到100%(电流密度为3A/dm2)。
6.电镀铈

图8-10 [BMIm]PF6-CeCl3-EG电解液中在铜上电镀30min得到的铈镀层的扫描电镜照片
以一氯丁烷、N-甲基咪唑和KPF6为原料合成了1-丁基-3-甲基咪唑六氟磷酸盐离子液体([BMIm]PF6),在该离子液体中加入乙二醇(EG)和CeCl3可得到电镀铈的电解液。
保持镀液温度在80℃下,不同沉积电势下在铜表面上电镀30min时得到的铈镀层的扫描电镜照片如图8-10所示。由图8-10可见,在[BMIm]PF6-CeCl3-EG电解液中电镀得到的铈镀层为颗粒状,且随着沉积电势的降低(-0.9~-1.4V),镀层微观颗粒的体积呈由小逐渐增大的规律。这是由于沉积电势较低时,电镀过程中不断有新的铈晶粒出现,晶核的数目不断增加,也就是说,在已经形成的晶核还没有来得及长大时,新的晶核又开始出现,从而得到了小颗粒、紧密状的镀层;而当沉积电势降低较多时,由于受扩散控制,新晶核形成的数量减少,而在已形成的晶核上继续长大的速率反而较快,因此得到了大颗粒、疏松状的镀层。
7.电镀硅
半导体材料的电镀极难在室温下进行,原因在于其卤素盐很容易在空气和水环境下分解。选择厌水厌氧的离子液体,可以解决室温下电镀硅的困难。传统电镀硅是在高温熔盐中进行的,但反应中会带来很多有毒、有害的物质,而且浪费能源。低温绿色环保的电镀方法成为一种必不可少的替代趋势。
由于用于电镀硅的前驱体SiCl4在水和氧气存在的环境中极易分解,电镀过程对环境要求很高,需要在氧含量和水含量都小于2mg/L的手套箱中进行,并且需要选择合适的离子液体。所谓合适的离子液体,需要具有高纯度、高电导率、低黏度等特点。下面介绍利用离子液体[Py1,4]Tf2N(1-丁基-1-甲基吡咯烷双三氟甲基磺酰亚胺盐)进行电镀硅的情况。
(1)基体对电镀硅的影响 如果想把电镀硅应用到器件上,就必然会涉及在不同基体上电镀的问题。图8-11给出了在0.1mol/LSiCl4+[Py1,4]Tf2N体系中,分别在ITO、Ni、Cu基体上的循环伏安曲线。可以看出,在ITO、Ni、Cu基体上都有反应发生。在Ni基体上,显示了不同的氧化还原过程,第1个还原峰位于-1.4V,第2个峰对应硅的还原。对于ITO和Cu基体,都具有良好的稳定性,完全能够满足电镀要求。硅单质在Cu基体上的还原峰为-2V左右。在-2~-3V范围内,Cu基体显示了一个交叉的CV曲线,这是还原过程中的不可逆形核造成的。
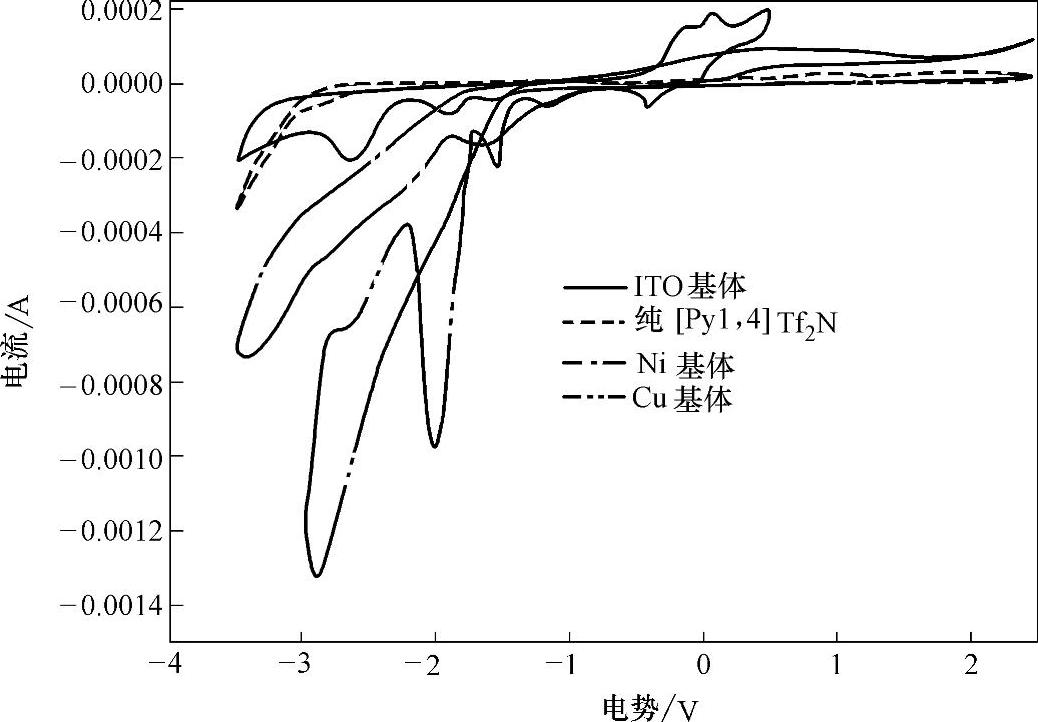
图8-11 0.1mol/LSiCl4+[Py1,4]Tf2N体系中不同基体上的循环伏安曲线
(2)温度对电镀硅的影响 利用恒电势法,在不同温度下(25℃、40℃、50℃、60℃)电镀30min。可以发现,在室温下得到的镀层相对均匀,由球形的纳米颗粒组成,直径约几纳米;在40℃下得到的镀层由几十纳米的较大颗粒组成,镀层中间存在褶皱,可能是由于ITO基体和硅镀层的热膨胀系数的差异导致的;在50℃下得到的硅镀层表面颗粒直径达几百纳米,这表明随着温度的升高,硅的晶粒变大;在60℃得到的镀层表面颗粒不清楚,镀层较薄,这可能是持续加热导致SiCl4挥发造成的。另外,温度过高,镀层表面的硅容易氧化。
(3)电解液浓度对电镀硅的影响 随着SiCl4浓度的增加,硅的还原电势发生负移。在0.1mol/L的电解液中,硅的还原电势约为-2.2V;而在0.2mol/L的电解液中,硅的还原电势约为-1.6V。
8.电镀锗
锗是重要的半导体材料,它具有高的介电常数,在近红外区有良好的透过性。锗的禁带宽度是随温度变化而变化的,在0K时禁带宽度为0.7437eV。锗的玻尔半径为24.3nm,其值大于一般半导体材料,纳米结构的锗更容易出现量子限域效应等性能。
关于离子液体电镀锗,目前主要是[EMIm]Tf2N离子液体电镀锗,下面做一简单介绍。
在手套箱中配置浓度为0.1mol/LGeCl4的[EMIm]Tf2N离子液体电解液,在ITO电极上测试了不同扫描速度下的循环伏安曲线,如图8-12所示。由图8-12可见,CV曲线上都出现了2个还原电流峰和1个氧化电流峰。随着电势向负方向扫描,当有第1个还原峰出现时,溶液中的颜色无变化,ITO电极表面也未见有沉积物出现;而当第2个还原峰出现时,发现ITO电极表面出现褐色沉积物,可以判定是由于锗的沉积导致的,即形成了锗镀层。当反向扫描时,电极表面的褐色物质又逐渐消失,这是锗的氧化过程。可以断定,第1个还原峰是Ge4+还原为Ge2+的还原峰,第2个峰是Ge2+还原为Ge单质的还原峰。
研究表明,在[EMIm]Tf2N离子液体电解液中,在-1.60V下恒电势电镀锗时,得到的锗镀层表面有微裂纹,但是没有完全开裂,表面粗糙,这说明镀层内部有拉应力产生。经扫描电镜观察,锗镀层是由Ge的团簇连接在一起组成的,颗粒粒径在50nm左右,团簇和团簇之间有空洞。经X射线能量色散光谱仪分析表明,镀层中Ge的质量分数为56.45%,Si和In的质量分数分别为1.25%和12.65%,Si和In分别来自于基体ITO玻璃,C、F和O的质量分数分别为5.31%、6.81%和17.53%,其中C部分是来自大气污染,也有一部分来自离子液体,F只能来自离子液体,O来自大气或离子液体。
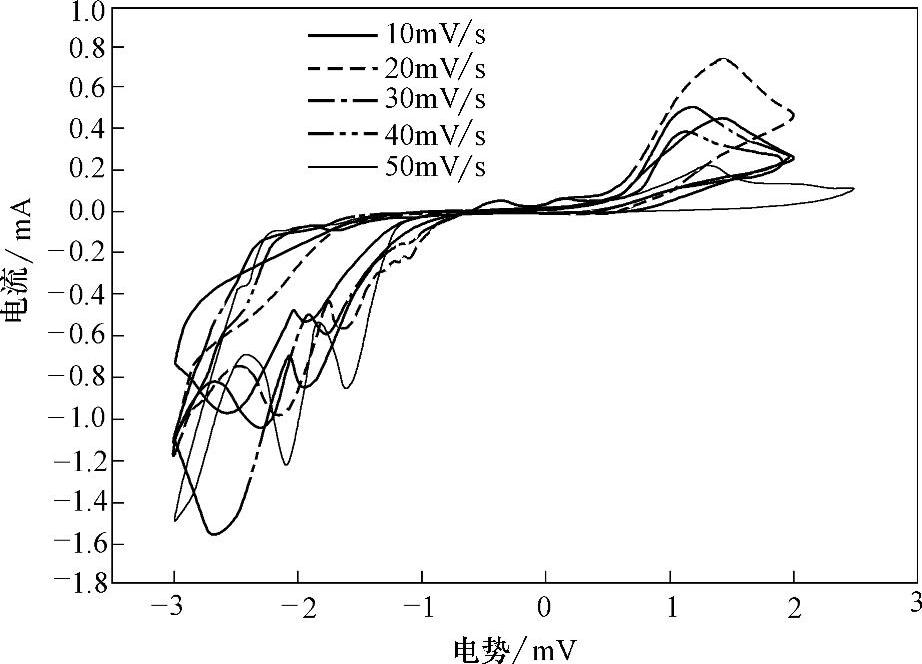
图8-12 GeCl4的[EMIm]Tf2N电解液中在ITO电极上不同扫描速度下的循环伏安曲线
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




