1.氢的性质
(1)氢的构成及热力性质 氢有三种同位素:相对原子质量为1的氕(符号H);相对原子质量为2的氘(符号D)和相对原子质量为3的氚(符号T)。氕(通称氢)和氘(亦称重氢)是稳定的同位素,氚则是一种放射性同位素,半衰期为12.26年。氚放出β射线后转变成He。氚是极稀有的,在1018个氢原子中只含有0.4~67个氚原子,所以自然氢中几乎全部是氕(H)和氘(D),它们的含量比约为6400∶1。由于氢的来源不同,比值会略有变化。不论是哪种方法获得的氢,其中氕的质量分数高达99.987%,氕(D)的质量分数的范围在0.013%~0.016%之间。事实上,因为氢是双原子气体,所以绝大多数的氘原子都是和氕原子结合在一起,形成氚化氢(HD)。分子状态的氘D2在自然氢中几乎不存在。因此,普通的氢实际上是H2和HD的混合物,HD在混合物里的质量分数在0.026%~0.032%之间。
在通常状况下,氢是无色、无味、无嗅的气体,极难溶解于水。氢是所有气体中最轻的,标准状态下的密度为0.0899kg/m3,只有空气密度的0.06954。在所有的气体中,氢的比热容最大、热导率最高、粘度最低。氢分子以超过任何其他分子的速度运动,所以氢具有最高的扩散能力,不仅能穿过极小的空隙,甚至能透过一些金属。如钯(Pd)从240°C开始,便可被氢渗透。氢的转化温度比室温低得多,其最高转化温度约为204K。因此,必须把氢预冷到该温度以下,再节流膨胀方能产生冷效应。
众所周知,氢是一种易燃、易爆物质。氢气在氧或空气中燃烧时,产生几乎无色的火焰(若氢中不含杂质),其传播速度很快,达2.7m/s;着火能很低,为0.2mJ。在大气压力及293K时,氢与空气混合物的燃烧体积分数范围是4%~75%,当混合物中氢的体积分数为18%~65%时,特别容易引起爆炸。因此,进行液氢操作时需特别小心,而且对液氢纯度需进行严格的控制与检测。
氢不仅在低温技术中可以用作工质,或者液化之后可作为低温冷却剂,而且还是比较理想的清洁能源。在火箭技术中,氢被用作推进剂,同时利用氢为原料还可以生产重氢,以满足核动力的需要。
(2)氢的正-仲态转化 由双原子构成的氢分子H2内,由于两个氢原子核自旋方向的不同,存在着正、仲两种状态。正氢(o—H2)的原子核自旋方向相同,仲氢(p—H2)的原子核自旋方向相反。正、仲态的平衡组成与温度有关。表30-3列出了不同温度时平衡状态的氢(称为平衡氢,用符号e—H2表示)中仲氢的摩尔分数。
表30-3 不同温度时平衡状态的氢中仲氢的摩尔分数
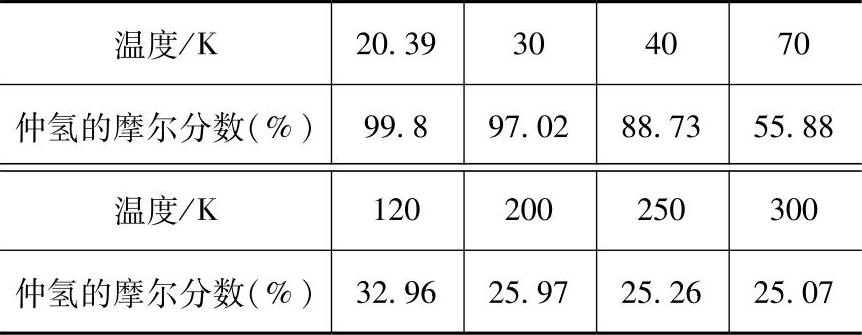
在通常温度下,平衡氢是含75%(质量分数)正氢和25%(质量分数)仲氢的混合物,称为正常氢(或标准氢),用符号n—H2表示。高于常温时,正-仲态的平衡组成不变;低于常温时,正-仲态的平衡组成将发生变化。温度降低,仲氢所占的质量分数增加。如在液氢的标准沸点时,氢的平衡组成为正氢0.20%和仲氢99.8%(实际应用中则可按全部为仲氢处理)。
在一定条件下,正氢可以变为仲氢,这就是通常所说的正-仲态转化。在气态时,正-仲态转化只能在有催化剂(触媒)的情况下发生;液态氢则在没有催化剂的情况下也会自发地发生正-仲态转化,但转化速率很缓慢。譬如液化的正常氢,最初具有原来的气态氢的组成,但是仲氢的摩尔分数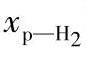 将随时间而增大,可按下式近似计算:
将随时间而增大,可按下式近似计算:
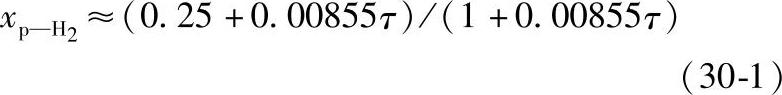
式中 τ——时间(h),若时间为100h,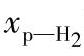 将增大到59.5%。
将增大到59.5%。
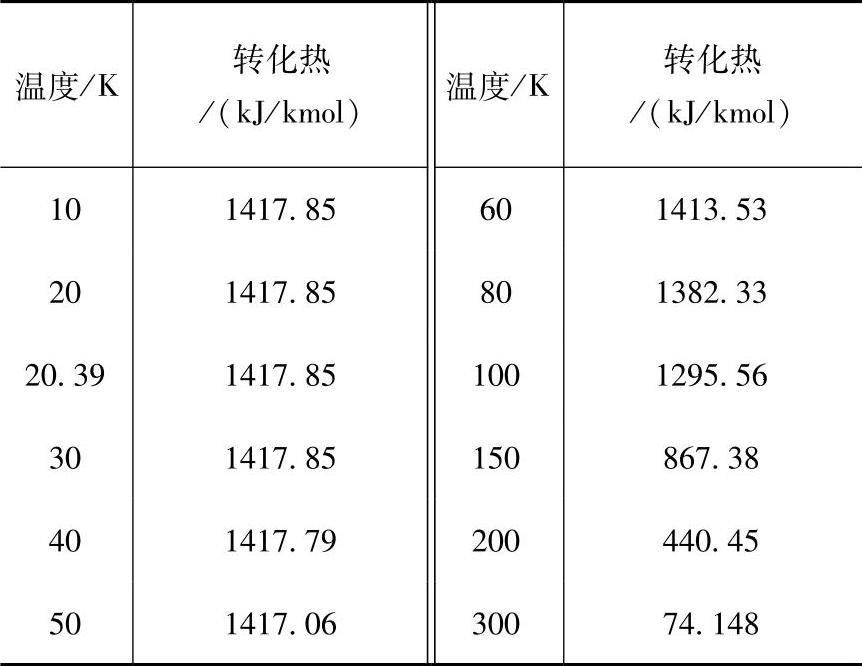
氢的正-仲态转化是一放热反应,转化过程中放出的热量和转化时的温度有关。不同温度下,正-仲氢转化时的转化热见表30-4。由表30-4可知,氢的正-仲转化热随温度升高而迅速减小。在低温(T<60K)时,转化热实际上几乎保持恒定,约等于706kJ/kg。
表30-4 正-仲氢转化时的转化热
正常氢转化成平衡氢所释放的热量见表30-5。由表30-5可见:正常液态氢转化成平衡氢时,放出的热量超过汽化潜热(447kJ/kg)。由于这一原因,即使在一个理想的绝热容器中,在正-仲态转化期间,贮存的正常液态氢亦会发生汽化,在开始的24h内约18%的液氢要蒸发损失掉,100h后损失将超过40%。为了减少液氢在贮存中的蒸发损失,通常是在液氢生产过程中,采用固态催化剂来加速正-仲态转化反应。最常用的固态催化剂有活性炭、金属氧化物、氢氧化铁、镍、铬或猛等。催化转化过程一般在几个不同的温度级进行,如65~80K、20K等。
表30-5 正常氢转化成平衡氢所释放的热量
如果使液态仲氢蒸发和加热,甚至当温度超过300K时,它仍将长时间地保持仲氢态。欲使仲氢重新变回到平衡组成,在存在催化剂(可用镍、钨、铂等)的情况下,要将其加热到1000K。在标准状态下,正常氢的沸点是20.39K,凝固点为13.95K;平衡氢的沸点是20.28K,凝固点为13.81K。
由于氢是以正、仲两种状态共存,故氢的物性要视其正、仲态的组成而定。正氢和仲氢的许多物理性质稍微有所不同,尤其是密度、汽化热、熔解热、液态的导热率及声速。然而,这些差别是较小的,工程计算中可以忽略不计。但在80~250K温度区间内,仲氢的比热容及导热率分别超过正氢将近20%。
2.氦的性质
(1)氦4(He4) 氦有两种同位素:He4和He3。He4是最常见的一种。常规氦气中含有1.3×10-4%的He3,因此通常所讲的氦是指气态氦,液氦是指液态氦,都是指He4,除非是特别指定。液氦(LHe4或简写为LHe)的标准沸点为4.214K,在此沸点时的密度为124.8kg/m3,也即为水的1/8。液氦在101.3kPa压力下无凝固点。事实上在液氦的蒸汽压下,即使温度降到0K,液氦也不会凝固。在0K时,液氦必须压缩到2529.8kPa的压力下才能凝固,如图30-1所示,液氦无色无味,而且折射率与气态氦很相近(液氦的折射率为1.02)。液氦在标准沸点时的汽化潜热为20.9kJ/kg,这仅仅是水的1/110。
尽管氦是稀有气体,而且也是最难液化的气体之一,但是它存在不同寻常的特性,以至于比其他的低温液体更多地成为实验和理论探索的对象。从图30-1中可以明显看出,He4的相图与其他物质明显不同,不存在氦的固、液、气三相点。LHe有两种不同的液相:液氦Ⅰ(HeⅠ)为正常液体,液氦Ⅱ(HeⅡ)为超流体。区分两种液相的相转变曲线叫λ线。λ线与蒸汽压曲线相交的点叫λ点,此点上温度为2.172K,压力为5.073kPa。(https://www.xing528.com)
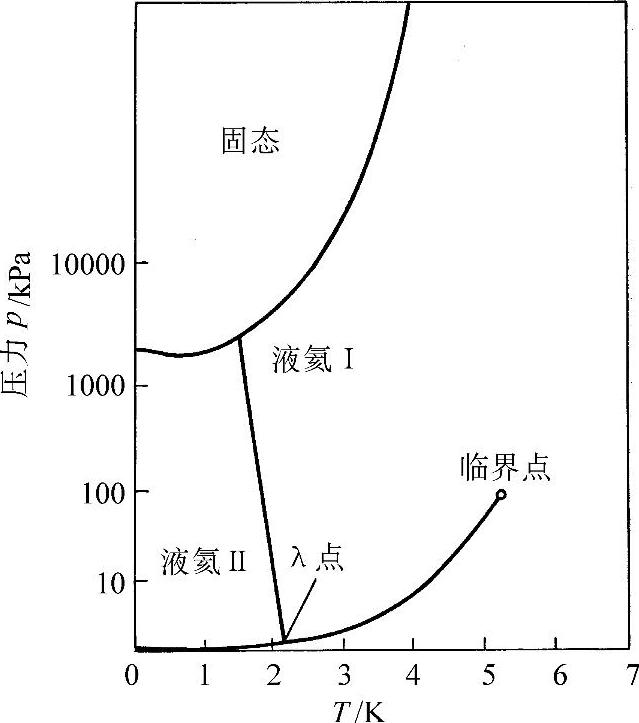
图30-1 氦4相图
从图30-2中可以看出,液氦的比热容与温度的关系与一般液体不大相同。温度在λ点附近时,液体比热容有一个大幅度跳跃。比热容曲线的形状有些像希腊字母λ,特命名比热容的温度突变点为λ点。人们最初认为从氦Ⅰ到氦Ⅱ的转化,是一种二阶相变,可是以后的研究表明,这种转化是一个更复杂的过程。由于液氦比热容与其他液体有如此不同的特性,它的热力性能和传输性能也表现出不同寻常。氦Ⅰ的热导率随温度的下降而下降,这类似于气体的热导率变化。
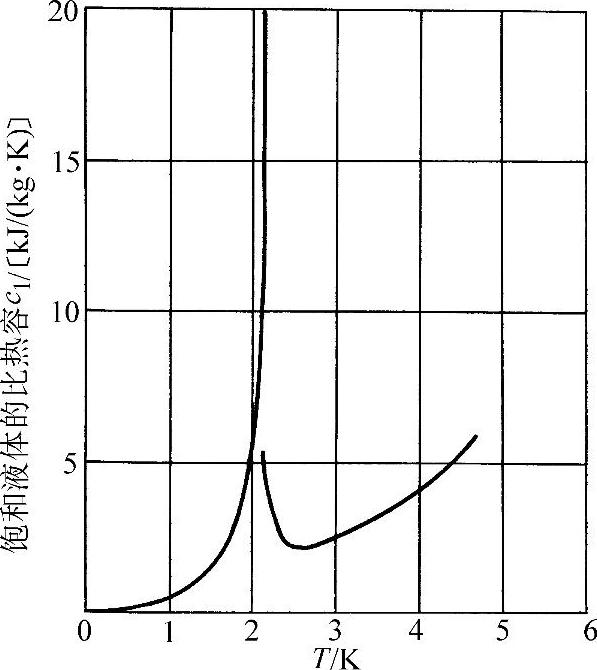
图30-2 饱和液态氦4的比热容
液氦Ⅱ有很有趣的热传递现象:当装有液氦Ⅰ的容器用泵减压,液体剧烈沸腾(沸腾情况与泵的抽速有关)。在泵工作期间,液面上的压力降低,液体发生沸腾,液体的温度也不断降低,当温度降到λ点,液体变成了液氦Ⅱ,所有沸腾现象突然中止,液体变得透明且气液表面十分平静,但此时在液面上仍在迅速蒸发。液氦Ⅱ的热导率非常大,在气泡生成之前,热量就已迅速传到液体表面,使液体中无法生成气泡。液氦Ⅰ在3.3K时的热导率大约为24mW/(m·K),液氦Ⅱ的热导率则高达85kW/(m·K),远高于常温下纯铜的热导率。由于用一般方法确定的液氦Ⅱ热导率不仅与温度有关,而且还与温度梯度和容器的尺寸相关,因此确定液氦Ⅱ的热导率还有一定的问题,但液氦Ⅱ的这种特性在自然界是独一无二的,它已成为超导磁体冷却的最佳制冷剂。
液氦Ⅱ的另一个不同寻常的特性是它的超流性。在特定条件下,它表现出粘度为零。在对液氦Ⅱ的特性的解释上,液氦由两种流体组成的理论得到了证明(Landau,1941),即常流体和超流体组成液氦Ⅱ,超流体的熵为零,能无摩擦地通过其他液体和固体的表面。根据这种理论,液氦Ⅱ是一种由常流体和超流体组成的混合物,其常流体质量和超流体质量比随温度的变化而变化,见表30-6。在0K时,液氦为100%的超流体;在λ点,液氦为100%常流体。
表30-6 两流体模型中常流体在液氦Ⅱ中的质量比
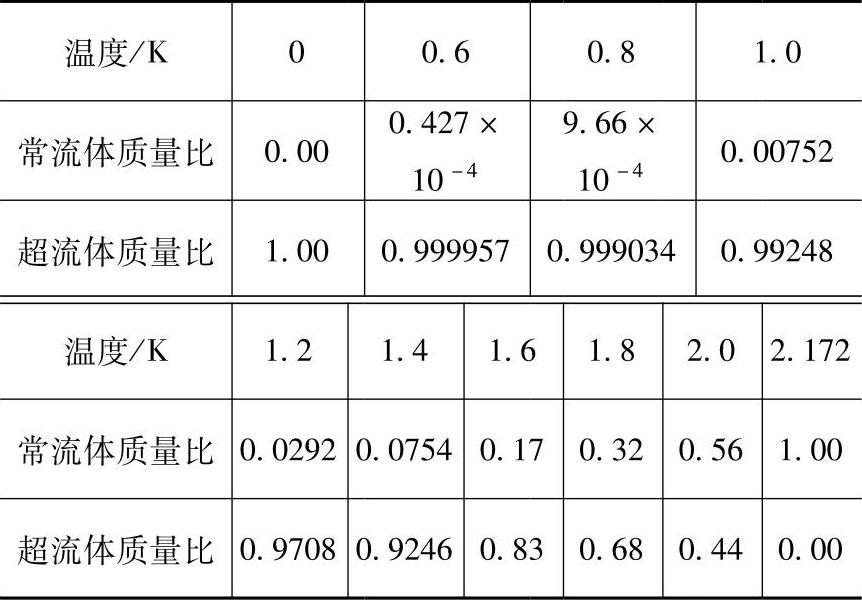
注:超流体含量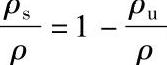 。
。
对液氦Ⅱ定点加热,使被加热点周围局部温度升高,导致局部常流体氦分子含量增加,而超流体氦分子含量减少。为平衡超流体氦的含量,超流体会通过液体向此处移动。由于超流体无摩擦运动,因此移动非常迅速。所以,液氦Ⅱ所表现出的高表观热导率,主要是由于迅速的对流过程而非单一的热传导。这种传热机制也用来解释液氦Ⅱ的“喷泉效应”(Al-lenand Jones,1938;Keller,1969)。如图30-3所示,当加热装置中的粉末时(例如从外部射进一束光),局部温度的上升将导致粉末中常流体氦含量增大,装置外的超流体氦将流入该装置以平衡含量。由于常流体氦的粘性,它不能在粉末状结构中通过小孔出口迅速离开,而超流体氦的流入,使管内氦量迅速上升,最终液体喷出末端毛细管口形成喷泉,高度可达25~30cm。
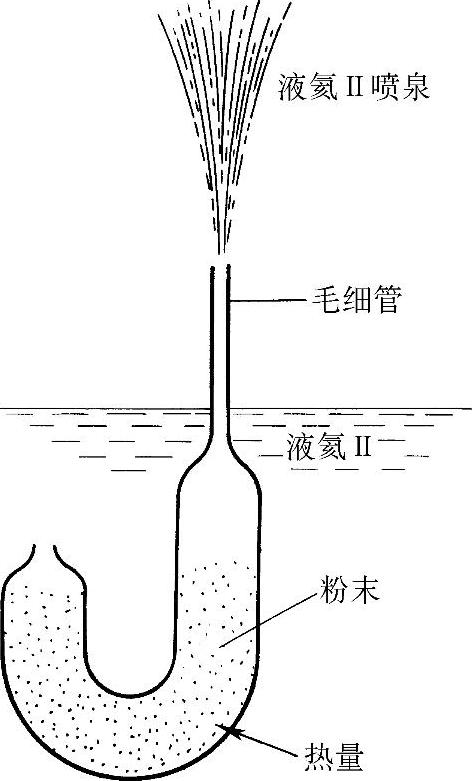
图30-3 液氦Ⅱ中的喷泉效应
超流氦的另一种独特的现象是爬行膜,如图30-4所示。如果一烧杯装入从大容器中取出的液氦Ⅱ,烧杯置于大容器的上方,可看到一层液氦薄膜(约30mm厚)爬上烧杯的内侧,越过杯顶,落回大容器中。如果烧杯是空的,并且有一半浸入液氦Ⅱ中,爬行膜将会爬上外壁,进入杯内,直到杯内液面与杯外相平。爬行膜的速度与膜的温度和膜所越过的表面条件有关。
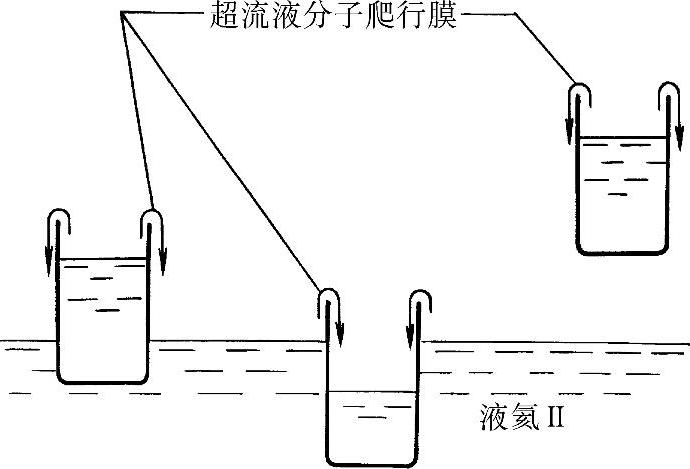
图30-4 液氦Ⅱ中的爬行膜现象
第二声是发生在液氦Ⅱ中的另一种有趣的现象。第二声类似于普通声音,有一个确定的速度(不同于第一声或普通声音的速度),而且形成了驻波,第二声波会被反射。第二声与普通声音不同之处,在于它由温度波或温度的局部振荡构成,而普通声音由压力波或压力的局部振荡构成。1939年Tizsa从理论上预言了第二声现象。大约7年后,Peshkov用实验观察到了它。第二声的速度随温度而变化,λ点的第二声速为零,在0K时,第二声速达239m/s。
(2)氦3(He3) 液氦3是一种无色无味的液体,标准沸点为3.19K,此沸点下的密度为58.9kg/m3。汽化潜热为8.49kJ/kg,这个值很小,以至于早期的研究者们怀疑在大气压下能否液化氦3。与液氦4一样,液氦3在蒸汽压下,即使降到0K也保持为液态。如图30-5所示,要使氦3凝固,氦3必须在0.32K时被压缩到2930.3kPa,才能到达凝固曲线的最低点。液态氦3在低温下的特点,显然不同于液氦4,这是因为由于原子量的不同和氦3的原子核里有奇数个粒子,而氦4有偶数个粒子所造成的量子效应所引起。液氦3在大约3.5mK时,完成了另一种型式的超流体转变。
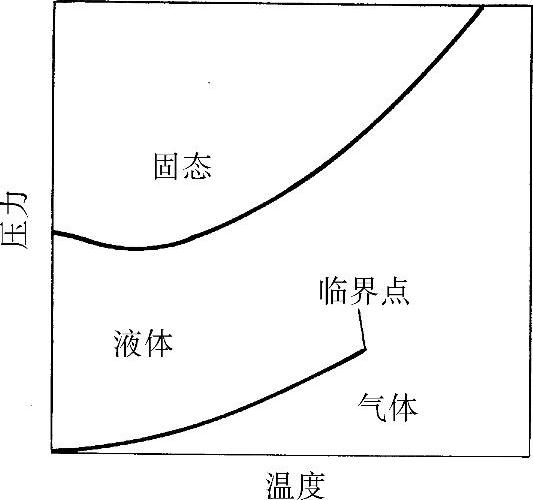
图30-5 氦3的相图
液氦3和液氦4的混合物也显示出一些独特的性质。在0.827K以下的温度,液氦3和液氦4的混合物自发地分离为两相:一相是超流体(富含氦4相),另一相是常流体(富含氦3相)。这种相的分离现象成为氦稀释制冷剂的基础,用它成功地获得了1K以下的低温。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




