日常生活中,人们经常用到的盐除NaCl外,还有Na2CO3、NaHCO3等。Na2CO3俗名纯碱,但属盐类。那么,为什么称之为“碱”呢?
思考与交流 根据以下实验的现象,想一想,同样是盐类物质的溶液,为什么它们的水溶液有不同的酸碱性呢?
【实验5-3】把少量的CH3COONa、NH4Cl、NaCl、CH3COONH4晶体分别投入4支盛有少量水的试管中,振荡试管使之溶解,然后用pH试纸分别测定其酸碱性。

可以看出,CH3COONa、NH4Cl、NaCl、CH3COONH4都属盐类,但其水溶液有的显酸性,有的显碱性,还有的显中性。这是什么原因造成的呢?
1.强碱弱酸盐的水解
CH3COONa从反应的酸和碱来看是由强碱(NaOH)和弱酸(CH3COOH)中和生成的盐,即强碱弱酸盐。它在水溶液中存在着下列解离及反应:

反应中,CH3COONa解离出的CH3COO-跟H2O解离出的H+结合生成了弱电解质CH3COOH,消耗了溶液中的H+,使H2O的解离平衡向解离的方向移动,溶液中的OH-浓度随之增大,当达到新的平衡时,溶液中[H+]<[OH-],溶液显碱性。上述反应的总反应(结果)可表示为
![]()
这种在溶液中盐的离子跟水解离出来的H+或OH-生成弱电解质的反应,叫做盐的水解。
Na2CO3、NaHCO3与CH3COONa都属于强碱弱酸盐,它们的水溶液都显碱性。
2.强酸弱碱盐的水解
NH4Cl从反应的酸和碱来看是由强酸(HCl)和弱碱(NH3·H2O)所生成的盐,即强酸弱碱盐。它在水溶液中解离出NH4+、Cl-,由于NH4+与H2O解离出的OH-结合生成了弱电解质NH3·H2O,消耗了溶液中的OH-,使H2O的解离平衡向解离的方向移动,溶液中的H+浓度随之增大,当达到新的平衡时,溶液中[H+]>[OH-],溶液显酸性。上述反应的总反应(结果)可表示为
![]()
其他如(NH4)2SO4、NH4NO3等盐的水解都属于这种类型,它们的水溶液都显酸性。
上述几种类型的盐能够发生水解,根本原因在于组成盐的离子能跟水解离出来的H+或OH-结合生成弱电解质。
思考与交流
1.想一想,由强酸和强碱生成的盐(如NaCl)在水溶液中能否发生水解?
2.三氯化铁(FeCl3)遇水会发生水解。现欲配制某一定浓度的FeCl3溶液,你认为应如何配制?
■资料卡片
在配制某些易水解的盐(如SnCl2、FeSO4)溶液时,要防止它们的水解。例如,测定磷时所用的SnCl2溶液,只有在极浓和高酸度下才是清亮的,若稀释时,就水解生成碱式盐。
![]()
所以在配制SnCl2溶液时,为了防止水解,通常是先将SnCl2溶于较浓的盐酸中,然后再用水稀释到所需浓度。
■生活中的化学
十二水合硫酸铝钾[KAl(SO4)2·12H2O],俗称明矾,是无色晶体,易溶于水,其解离出的Al3+与水发生水解反应。
![]()
生成的Al(OH)3(胶体)具有很强的吸附能力,可以吸附水中悬浮的泥沙等杂质,并形成絮状不溶物沉降下来,使水澄清。因此,在以井水、河水或池塘水为生活用水主要来源的地区,明矾是一种较好的净水剂。
课堂反馈
将下列物质溶于水后,水溶液的酸碱性如何?
碳酸钾 氯化铵 硝酸钾 醋酸钠
■实践活动
食醋是人们日常生活中必备的调味品之一。食醋中含有醋酸,具有一定的酸度,请你在老师的指导下,设计实验,测出食醋中醋酸的含量。
■资料卡片
酸碱滴定法是以酸碱中和反应为基础的一种滴定分析方法,其离子反应为
![]()
在酸碱滴定中,已知准确浓度的溶液称为标准溶液;含有被测组分的溶液称为待测液;用滴定管(图5-4-1)滴加已知准确浓度的操作称为滴定;当加入的标准溶液与被测物质的组分按化学式计量关系完全反应时,反应达到了化学计量点;化学计量点一般是用外加试剂的颜色改变来判断的,这种借助颜色变化来判断化学计量点的试剂称为指示剂。我们把指示剂的变色点叫做滴定终点。
酸碱滴定常用的指示剂有甲基橙、甲基红、酚酞等。

图5-4-1
知识梳理
一、电解质
1.强弱电解质的比较

2.判断电解质与非电解质应注意的问题
(1)电解质和非电解质都是指化合物,是纯净物。单质、混合物既不是电解质,也不是非电解质。
(2)一种化合物不论是在水溶液里还是在熔融状态下能导电,都属于电解质;而非电解质必须是在这两种情况下均不导电的化合物。
(3)电解质是化合物,自身在水溶液中电离出离子而使得溶液导电,像SO2、NH3,两者的水溶液虽能够导电,但不能说二氧化硫、氨气是电解质。因为导电的离子不是它们电离出来的,而是由它们与水作用分别生成H2SO3、NH3·H2O两种电解质所致。类似的还有SO3、CO2、P2O5等。
(4)电解质不一定导电,导电的物质也不一定是电解质。
二、离子方程式
1.离子方程式是_______________________________________________________。
2.书写步骤:
(1)写:_____________________________________________;
(2)改:_____________________________________________;(https://www.xing528.com)
(3)删:_____________________________________________;
(4)查:_____________________________________________。
3.离子反应的本质是___________________________________________________。
4.复分解型离子反应发生的条件是:_______、________、________。
5.离子方程式的正误判断原则
(1)看离子反应是否符合客观事实,不可主观臆造产物及反应。
(2)看表示各物质的化学式、离子符号是否正确。
(3)看沉淀、气体等符号是否正确。
(4)看方程式两边电荷总数是否相等、原子个数是否相等。
(5)离子方程式一般指在溶液中进行的化学反应,对于固体和固体、固体和气体、气体和气体的反应不写离子方程式。
6.离子共存
离子间不发生化学反应(不生成沉淀、气体、难电离的物质)就可以大量共存。
知识检测站
1.下列物质中,能够导电的电解质是( )。
A.Cu丝 B.熔融的MgCl2 C.NaCl溶液 D.蔗糖
2.下列物质中,不能电离出酸根离子的是( )。
A.Na2S B.Ba(OH)2 C.KMnO4 D.KCl
3.下列物质的水溶液能导电,但属于非电解质的是( )。
A.HClO B.Cl2 C.NaHCO3 D.CO2
4.下列说法正确的是( )。
A.强电解质一定是离子化合物,弱电解质一定是共价化合物
B.强电解质一定是易溶化合物,弱电解质一定是难溶化合物
C.SO3溶于水后水溶液导电性很强,所以SO3是强电解质
D.属于共价化合物的电解质,在熔化状态下一般不导电
5.关于酸、碱、盐的下列各种说法中,正确的是( )。
A.化合物电离时,生成的阳离子是氢离子的是酸
B.化合物电离时,生成的阴离子是氢氧根离子的是碱
C.化合物电离时,生成金属阳离子和酸根离子的是盐
D.NH4Cl电离的电离方程式是![]() ,所以NH4Cl是盐
,所以NH4Cl是盐
6.能用![]() 表示的是( )。
表示的是( )。
A.NaOH溶液和CO2的反应
B.Ba(OH)2溶液和稀H2SO4的反应
C.NaOH溶液和盐酸反应
D.氨水和稀H2SO4的反应
7.在某无色透明的酸性溶液中,能共存的离子组是( )。
A.Na+、K+、SO42-、HCO3- B.Cu2+、K+、SO42-、NO3-
C.Na+、K+、Cl-、NO3- D.Fe3+、K+、SO42-、Cl-
8.能正确表示下列化学反应的离子方程式的是( )。
A.氢氧化钡溶液与盐酸的反应![]()
B.澄清的石灰水与稀盐酸反应![]()
C.铜片插入硝酸银溶液中![]()
D.碳酸钙溶于稀盐酸中![]()
9.加入适量的硫酸溶液,可使溶液中下列离子数量显著减少的是( )。
A.Cl- B.Ba2+ C.NO3- D.Na+
10.将BaCl2溶液分别滴入到K2SO4、稀H2SO4溶液中,均有________产生,它们的离子方程式是__________________,说明离子方程式不仅表示一定物质间的______________________,而且表示了______________________离子反应。
11.现有①铁片②NaCl③氨水④醋酸⑤酒精⑥盐酸⑦浓H2SO4⑧KOH⑨蔗糖⑩H2S,其中属于电解质的是_____________,属于非电解质的是_____________,属于强电解质的是______________,属于弱电解质的是____________。
12.写出下列反应的离子方程式。
(1)用稀硫酸清洗铁锈(Fe2O3)
(2)碳酸钠溶液与盐酸混合
(3)硫酸铜溶液和氢氧化钡溶液混合
(4)向足量澄清石灰水中通入二氧化碳
13.把下列离子方程式改写成化学方程式。
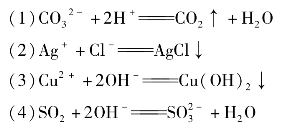
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




