(一)气体的实验
许多学生做气体实验时,常常感到手忙脚乱、顾此失彼、难于控制,这与气体反应速度较快,实验准备工作不够,操作动作不协调等有关。
做气体实验最怕的是实验未完成而气体断源,解决这个问题的办法是要准备足量的制气体的药品。如制氧气时,把氯酸钾和二氧化锰的混合物或高锰酸钾准备足量。制氢气时,把锌粒准备过量,盐酸或稀硫酸放在手边,以备气流不足时随时添用。还要注意的是,做气体实验前,认真检查装置的气密性,以防实验过程中漏气。
用排水法收集气体前,应该把准备集气用的集气瓶装满水倒扣在水槽中,不要等到收集时,再向集气瓶中注水,这既耽搁了时间,又会浪费不少气体。另外,水槽里盛的水不能太多,一般以半槽为宜,不然,当排水集气时,集气瓶里的水进入水槽而使水溢出。为了便于集气,最好在水槽里放置集气瓶座,把充满水的集气瓶放在瓶座上,这样就可以腾出手来做其他操作。还需注意导管能否灵活移动,如不够灵活,应该找出原因,及时进行调整或更换。
做气体实验和其他实验一样,一定要注意安全。如在收集完氧气后,要先把导管从水中取出,再移开加热用的酒精灯,以免水槽里的水倒流进试管发生事故。再如,点燃氢气前,一定要检验纯度,以防氢气不纯发生爆炸。另外,做实验时要情绪稳动,克服恐惧,动作连贯,操作规范,千万不要喧哗、嬉闹,实验环境杂乱也会直接影响实验效果。
做氢气还原氧化铜等较大型气体实验时,组装仪器应从左向右,先装氢气发生器,再装加热氧化铜的装置,最后用导管连接它们。经过检查气密性并证明气体流向畅通,才能装进药品做实验,不要急于求成。实验过程中,要严格遵守操作规则,先通氢气,排净整个装置中的空气,再加热氧化铜,看到明显实验现象后,移开酒精灯,继续通氢气直至冷却。
(二)物质提纯的方法
研究任何一种物质的性质,都必须取用纯净物,因为一种物质里如果含有杂质,就会影响这种物质固有的某些性质,因此必须进行物质提纯。物质提纯的方法应该根据混合物中各组分的性质来选择。结合具体情况,可以用物理或化学的方法,使不纯物质变为比较纯的物质。物质提纯的物理方法常见的有过滤法、结晶法、蒸馏法、分液法、萃取法等,如实验室制取氧气后,试管里残留的二氧化锰可以提取出来循环使用,则要将二氧化猛中混入的氯化钾除去,可采用过滤法,因为混合物中的二氧化锰不溶于水,氯化钾易溶于水。
如果用化学方法提纯物质,应该设法使杂质变成易与主要组分分离的物质,或与主要组分相同的物质,不要经化学处理后又混入新的杂质。如除去一氧化碳中混入的二氧化碳杂质,可以用氢氧化钠溶液洗气,使二氧化碳跟氢氧化钠反应而溶解,与一氧化碳分离。再如,除去氯化钾中混入的碳酸钾杂质,可以用加盐酸的方法,使碳酸钾跟盐酸反应变成二氧化碳与氯化钾,若把盐酸换成硫酸,虽也能跟碳酸钾反应变成二氧化碳,达到与氯化钾分离的目的,但是会引入新的杂质硫酸根离子。
原理:K2CO3+2HCl═2KCl+CO2↑+H2O
K2CO3+H2SO4═K2SO4+CO2↑+H2O
(三)检验物质成分的实验
用实验的方法检验物质成分所考查的类型很多,主要包括:已知物质成分的验证、鉴定某物质中是否含有某种成分、几种未知物的鉴别等。首先应该弄清楚实验所要求的是哪个类型,根据要求来设计实验方案,然后才能动手实验。
已知物质成分的验证是用实验方法证明某已知物质确实含有某些成分,如验证胆矾里含有铜、硫酸根和结晶水,根据胆矾的性质,用直接加热分解得到无水硫酸铜和水,证明它含有结晶水;把胆矾(或受热分解后的无水硫酸铜)配成硫酸铜溶液,加入氯化钡生成不溶于稀硝酸的硫酸钡沉淀,证明它含有硫酸根;将铁钉或锌片放入硫酸铜溶液能置换出金属铜,证明它含有铜。
鉴定某物质是否含有某成分,应该利用某成分的特征反应加以判断,如要问某矿石是否含有碳酸盐,应该利用碳酸盐跟盐酸反应放出二氧化碳的特征反应进行判断。再如,要问某溶液是否含有氯离子,应该利用硝酸银溶液中的银离子跟氯离子生成不溶于稀硝酸的氯化银沉淀进行判断。
鉴别几种未知物质,应根据几种物质在同一反应中表现出的不同现象(或不反应)加以区分,选用的方法要简便易行。如鉴别氧气、氮气、氢气和二氧化碳4种气体,需要分两步鉴别:第一步是用燃着的木条分别接触4种气体,使木条燃烧更加剧烈的是氧气,能把气体点燃的氢气,使木条熄灭的氮气和二氧化碳;第二步是用澄清的石灰水鉴别,使石灰水变浑浊的是二氧化碳,另一种气体则是氮气。
(四)掌握定量实验
初中化学实验里有些属于定量实验,如配制一定溶质质量分数的溶液、测定硝酸钾的溶解度等。做定量实验前,根据要求事先计算出有关数据,如将37%(密度为1.19g/cm3)的浓盐酸稀释成200g20%的稀盐酸,首先要计算确定出需用多少毫升浓盐酸,多少毫升水。
做定量实验要使用托盘天平、量筒等仪器。应该掌握物质的称量和液体的量取等定量实验的基本操作,如使用托盘天平时,应左盘放称量物,右盘放砝码,用镊子夹取砝码,用称量纸或容器盛放称量物等。
选择量具时,要注意与所做的定量实验规格相适应,如使用量筒量取一定体积液体时,先计算出需要量取液体的体积,再选择合适的量筒。像上述配制20%的稀盐酸,要量取90.91mL的浓盐酸,应该选择容积为100mL的量筒,不能选择50mL量筒,分2次量取,更不能用10mL量筒,分10次量取。因为多次量取的过程中,由于操作、观察等引起的误差总和比一次量取的大。另外,量筒属于较粗略量取液体体积的仪器,一般只能观察精确到整数位,第一位小数是估读出来的,不够精确。做定量实验时,应该仔细、认真,不要洒出、掉落药品或混入杂质而影响实验的精确度。
(五)物质的鉴别
鉴别就是根据物质性质的不同及有关实验现象的不同,将它们一一区别开。经常遇到的物质鉴别有气体鉴别,还有溶液的鉴别,也叫离子鉴别。
气体的鉴别是根据气体本身的特性来鉴别的。一般用到氧气能支持燃烧的性质,能使带有余烬的木条重新复燃,能使燃着的木条越着越旺的现象来鉴别氧气;用氢气的可燃性,氢气燃烧时的火焰是淡蓝色的,氢气燃烧后的产物只有水等特征来鉴别氢气;用一氧化碳的可燃性,一氧化碳燃烧时的火焰是蓝色的,一氧化碳燃烧后的产物是能使澄清石灰水变浑浊的二氧化碳等特征来鉴别一氧化碳;用到二氧化碳不支持燃烧,能使燃着的木条熄灭,能使澄清石灰水变浑浊等特征来鉴别二氧化碳气体;用氮气不支持燃烧,能使燃着的木条熄灭,不能使澄清石灰水变浑浊等特征来鉴别氮气。
酸、碱溶液鉴别则是根据酸、碱对指示剂显不同颜色来鉴别的。
Ag+、Cl-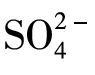
 等离子的鉴别也是根据这些离子与某些试剂反应的不同现象来鉴别的。鉴别Cl-用到硝酸银和稀硝酸两种试剂,鉴别
等离子的鉴别也是根据这些离子与某些试剂反应的不同现象来鉴别的。鉴别Cl-用到硝酸银和稀硝酸两种试剂,鉴别 用到氯化钡(或硝酸钡)和稀硝酸两种试剂,鉴别
用到氯化钡(或硝酸钡)和稀硝酸两种试剂,鉴别 用到强酸(如盐酸或硝酸)和澄清石灰水两种试剂,鉴别Ag+用可溶性的盐酸盐溶液(或盐酸)和稀硝酸两种试剂。
用到强酸(如盐酸或硝酸)和澄清石灰水两种试剂,鉴别Ag+用可溶性的盐酸盐溶液(或盐酸)和稀硝酸两种试剂。
在盐类鉴别(阴离子不同)时,鉴别顺序一般是先鉴别碳酸盐,然后鉴别硫酸盐、盐酸盐,当其他酸根阴离子都鉴别完以后,剩余的为硝酸盐。
1.用化学方法鉴别一氧化碳和二氧化碳
根据一氧化碳、二氧化碳两种气体性质的不同进行鉴别,有以下两种方法。
(1)取两支洁净的试管,分别倒入少量澄清的石灰水,然后将两个贮气瓶中的气体分别通入两支试管中,其中一支试管内的石灰水变浑浊,证明该气体是二氧化碳;另一支试管内的石灰水无变化,则该气体是一氧化碳。
原理:CO2+Ca(OH)2═CaCO3↓+H2O,CO与Ca(OH)2不反应
(2)将两个贮气瓶导管的阀门(活塞)打开,用燃着的木条接近导管口,其中一个气体能燃烧且发出蓝色火焰的,则证明该气体为一氧化碳;另一个使燃着的木条熄灭的,则是二氧化碳。
原理:2CO+O2═2CO2
2.鉴别氢气、一氧化碳、甲烷
分别点燃3种气体,在3个火焰的上方各罩一个冷而干燥的烧杯,过一会儿,会看到有两个烧杯的内壁变得模糊并有水蒸气凝结,则说明这两种气体中有一个是氢气,另一个是甲烷,在烧杯内壁没有水蒸气凝结的该气体一定是一氧化碳。
再向另外两个烧杯内分别注入少量澄清的石灰水,振荡,石灰水变浑浊的,说明该气体为甲烷;石灰水不变浑浊的,说明该气体为氢气。
3.鉴别氧气、氢气、氮气、空气、一氧化碳、二氧化碳
取6支试管,并分别倒入澄清的石灰水,然后将6个贮存气体的橡胶袋上的导管分别插入6支试管的石灰水中,打开止水夹,观察6支试管中石灰水的变化。其中一支试管中的石灰水变浑浊,此种气体必为二氧化碳,其他5支试管中无变化。关闭止水夹。
取一个水槽并放好水,再取5个集气瓶在其内部也全装满水并倒立在水槽中。将剩余的5种气体均采用排水取气法收集,并将此5瓶气体用玻璃片盖好,从水槽中取出,放置在桌面上。
将燃着的木条分别放在5个集气瓶的瓶口,观察现象。
其中一瓶气体能使木条越着越旺的,则一定是氧气。
其中一瓶对于木条燃烧没什么影响,而瓶中气体也没有燃烧现象的,则一定是空气。
其中一瓶能使燃着的木条熄灭的一定为氮气。
有两瓶气体在遇燃着的木条时,瓶中的气体被点燃了,且燃烧时的火焰均为淡蓝色,此时迅速往两个集气瓶中倒入少量澄清的石灰水,盖上玻璃片,摇动集气瓶,观察石灰水的变化。其中一瓶中的石灰水变浑浊,则原来的气体一定为一氧化碳,因为一氧化碳燃烧后生成二氧化碳,二氧化碳使石灰水变浑浊。而另一集气瓶中的石灰水没变化,则原来的气体一定为氢气,因为氢气燃烧只能生成水。
4.鉴别水、盐酸、氢氧化钠
取3支试管,分别倒入未知液1~2mL,然后各滴入紫色石蕊溶液2~3滴,振荡,观察现象。使石蕊溶液变红者,原液体为盐酸;使石蕊溶液变蓝者,原液体为氢氧化钠;石蕊溶液不变色仍为紫色者,原液体为水。
5.用一种试剂区分碳酸钾、硝酸银、硫酸锌溶液
取3支试管,分别倒入未知液1~2mL,然后各倒入1~2mL盐酸,观察现象。其中一支试管中有气泡放出,则原溶液为碳酸钾溶液。
原理:K2CO3+2HCl═2KCl+H2O+CO2↑
其中一支试管中有白色沉淀生成,则原溶液为硝酸银溶液。
原理:AgNO3+HCl═AgCl↓+HNO3
其中一支试管中既无气泡放出,也无白色沉淀生成,且无其他现象发生,则原溶液为硫酸锌溶液。
6.鉴别氯化钾、硝酸钾、碳酸钾、硫酸钾粉末
取氯化钾、硝酸钾、碳酸钾、硫酸钾4种白色固体粉末各1药匙,分别放入4个烧杯中,再向各烧杯中加适量蒸馏水使其完全溶解,得到4种无色溶液。
取4支试管,分别倒入未知液1~2mL,并向4支试管中加入1~2mL盐酸。其中一支试管中有气泡产生,则原物质为碳酸钾。
原理:K2CO3+2HC1═2KCl+H2O+CO2↑
再取3支试管,分别倒入余下的3种未知液1~2mL,并向3支试管中加入1~2mL氯化钡溶液,其中一支试管中有白色沉淀生成,再滴入1~2mL稀硝酸,如果白色沉淀不消失,则原物质为硫酸钾。
原理:K2SO4+BaCl2═BaSO4↓+2KCl
再取两支试管,分别倒入余下的两种未知液1~2mL,并向两支试管中加入1~2mL硝酸银溶液,其中一支试管中有白色沉淀生成,再滴入1~2mL稀硝酸,如果白色沉淀不消失,则原物质为氯化钾。(https://www.xing528.com)
原理:KCl+AgNO3═AgCl↓+KNO3
余下的一支试管中的原物质为硝酸钾。
7.如何鉴定一瓶无色液体为盐酸
盐酸溶液中的阳离子为氢离子(H+),阴离子为氯离子(Cl-)。如果通过一定的实验步骤和具体的实验现象能确定溶液中既含有氢离子又含有氯离子,就能确定该无色溶液一定为盐酸。
检验氢离子(H+):
(1)把两块锌粒放入1支试管中,取3~5mL待鉴定的无色溶液倒入试管中,用拇指堵住试管口,待试管中气体对拇指的压力较大时,移开拇指,立即用燃着的火柴点燃试管中的气体,如果气体安静燃烧或发出尖锐的爆鸣声,证明有氢气生成,也就证明原无色溶液中含有氢离子(H+)。
(2)用干燥洁净的玻璃棒蘸取待测无色溶液滴在蓝色石蕊试纸上,若蓝色石蕊试纸变红,则证明溶液中氢离子(H+)的存在。
检验氯离子(Cl-):
取1支试管,倒入待测溶液1~2mL,然后加入1~2mL硝酸银溶液,振荡,观察现象。如果有白色沉淀生成,再加入1~2mL稀硝酸,若沉淀不消失,则证明氯离子(Cl-)的存在。
该无色溶液中既含有氢离子(H+),又含有氯离子(Cl-),则此溶液为盐酸。
8.如何检验银离子(Ag+)
将少量盐酸或少量可溶性的盐酸盐溶液倒入盛有少量待测液的试管中,振荡,有白色沉淀生成时,再加入少量的稀硝酸,如果沉淀不消失,则证明Ag+的存在。
9.如何检验氢氧根离子(OH-)
(1)将紫色石蕊溶液滴入盛有少量待测液的试管中,振荡,如果石蕊溶液变蓝,则证明OH-的存在。
(2)用干燥洁净的玻璃棒蘸取未知液滴在红色石蕊试纸上,如果红色石蕊试纸变蓝,则证明OH-的存在。
(3)将无色的酚酞溶液滴入盛有少量待测液的试管中,振荡,如果酚酞溶液变红,则证明OH-的存在。
(4)用干燥洁净的玻璃棒蘸取未知液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便可知道溶液的pH,如果pH大于7,则证明OH-的存在。
10.如何检验硫酸根离子(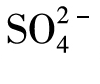 )
)
将少量氯化钡溶液或硝酸钡溶液倒入盛有少量待测液的试管中,振荡,有白色沉淀生成时,再加入少量的稀硝酸,如果沉淀不消失,则证明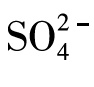 的存在。
的存在。
11.如何检验碳酸根离子( )
)
将少量的盐酸或硝酸加入盛有少量待测液的试管中,如果有无色气体放出,将此气体通入盛有少量澄清石灰水的试管中,如果石灰水变浑浊,则证明原待测液中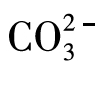 的存在。
的存在。
(六)化学实验用语辨析
1.“溶化”与“熔化”
“溶化”是指固体在水(或其他液体)中溶解,如蔗糖在水中溶化了,碘在酒精中溶化了。
“熔化”是指固体加热到一定程度变成了液态,如铁加热到1535℃时熔化成铁水,硫加热到112.8℃时即变成液态硫。
2.“蒸发”与“蒸馏”
“蒸发”是在加热条件下溶液里溶剂气化的过程,此操作能使溶液浓缩或溶质以晶体析出。蒸发一般在蒸发皿中进行,如氯化钠溶液经蒸发后可得氯化钠晶体。
“蒸馏”是利用液体混合物各组分的沸点不同,使液体气化而进行的分离操作,它是分离或提纯液态混合物的常用方法。蒸馏一般在蒸馏烧瓶中进行,如蒸馏水就是用蒸馏方法制取的。
3.“通入”与“插入”
“通入”一般指某气体通过导管进入某种溶液里,如把二氧化碳气体通入石灰水中。
“插入”一般指某种玻璃仪器放进另一种仪器中或某液体内,如把玻璃管插入橡胶塞中;在制二氧化碳实验中,为了防止气体从长颈漏斗逸出,需将漏斗下端插入液面以下。
4.“鉴别”与“鉴定”
“鉴别”是根据物质的特征将几种物质区分、辨别出来,如鉴别氯化钠和硫酸钠溶液,可用滴入氯化钡溶液的方法,产生白色沉淀的溶液为硫酸钠溶液,无变化的溶液为氯化钠溶液。
“鉴定”是要确定某物质的组成或某物质是否存在,如鉴定某白色晶体是否为氯化铵,就需证明该白色晶体中既含有铵根离子,又含有氯离子。又如,用滴加盐酸的方法可鉴定生石灰中是否含有石灰石。
(七)加速固体物质的溶解
加速固体物质的溶解一般有下面4种方法:
(1)将固体物质研磨成细的粉末。固体物质的颗粒越小,它跟溶剂接触的面积就越大,就越容易溶解。因此,在固体物质未放入溶剂以前,先将大颗粒的固体物质放在研钵中研磨,待研成细的粉末以后,再放入溶剂之中,这样可使溶解的速率加快。
(2)振荡。如果是在试管中进行少量固体物质的溶解,可以用振荡的方法加速固体物质的溶解。
(3)搅拌。如果是在烧杯中进行较多量固体物质的溶解,用玻璃棒不断搅拌溶液可以加速固体物质的溶解。
(4)加热。加热时可以增加分子运动的速率。另外,绝大多数固体物质的溶解度是随着温度的升高而增大的。因此,加热也可以使固体物质溶解度增大,溶解速率加快。
(八)如何检验气体发生装置是否漏气
在实验室制取氧气、氢气、二氧化碳等气体时都必须检查装置的气密性,只有装置不漏气时方可进行实验。
要检查装置是否漏气,应把导管的一端插入烧杯或水槽的水中,用手紧握试管或用手掌紧贴烧瓶的外壁,试管或烧瓶里的空气受热膨胀,导管口就会有气泡冒出。然后把手移开,过一会儿,待试管或烧瓶冷却后,水就从烧杯或水槽中流到导管里,形成一段稳定的水柱,则表明装置不漏气。
如果发现装置漏气,必须找出漏气的原因,并进行调整、修理,再次检验,直至装置不漏气时才能进行实验。
(九)过滤
过滤是把不溶性固体或没有溶解掉的固体跟液体分离的一种方法,如粗盐的提纯就是把粗盐溶于水,经过过滤,把不溶于水的泥沙等固体杂质跟食盐水分离。
1.过滤器
取一张圆形滤纸,先对折成半圆,再对折成四等分,然后打开使之成为圆锥形,把圆锥形的滤纸尖端部分向下,放入漏斗中,滤纸的边缘应比漏斗口稍低,约低5mm左右,把多余的滤纸剪去。用手压住滤纸,然后用水润湿滤纸,使滤纸紧贴漏斗的内壁,中间不要留有气泡。这样就做成一个过滤器。
2.过滤后滤液仍然浑浊的原因
承接滤液的烧杯不干净,倾倒液体时液面高于滤纸边缘,滤纸破损。
3.过滤时的注意事项
(1)滤纸没有紧贴漏斗内壁,会导致待过滤液从滤纸与漏斗间的空隙流下,导致过滤效果不佳。
(2)滤纸若高于漏斗边缘,则滤纸由于吸水变软而变形,有可能造成滤纸破损,过滤效果不佳。
(3)滤液若不低于滤纸边缘,则滤液使滤纸与漏斗间形成空隙,导致滤液直接从空隙流出,造成过滤效果不佳。
(4)盛待过滤液的烧杯尖口没有紧靠玻璃棒,即没有引流,有可能造成液滴飞溅。
(5)玻璃棒没有靠在三层滤纸处,有可能戳破滤纸,造成过滤效果不佳。
(6)漏斗末端没有靠在烧杯内壁,可能导致液滴飞溅。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




