1.荧光和磷光
(1)分子能级与电子能级的多重性
分子是通过各原子之间的化学键的相互作用而构成的,除了每个原子的核外电子在不断运动外,组成分子的各原子之间还有沿着键轴方向周期性变化和键角的周期变动,这些周期性变化我们称之为振动,还有整个分子沿着对称轴的转动等。量子力学证明,这些运动的能量都是量子化的,所以分子运动的量子化能级有:分子轨道的电子能级、分子振动能级和分子转动能级。
在无外界能量的影响下,分子的价电子都处于量子化能级的基态,用S0表示,即电子成对地填充在能量最低的轨道中。根据泡利不兼容原理,一个给定的轨道中的两个电子,必定具有相反的自旋方向,即自旋量子数s分别为+1/2和-1/2。其总自旋量子数S=0,即基态没有净自旋,基态的多重性2S+1=1,这种状态称为基态单重态。图3-1(a)表示分子1s22s22p2基态电子分布。
一个分子在获得能量后的激发过程,通常是一个电子从低能级轨道(成键轨道,基态)跃迁到量子化能级更高的空轨道(反键轨道,激发态)的过程。如果处于激发态的电子自旋方向没有发生改变,这时仍然没有净自旋,其多重性2S+1=1,电子所处的状态称为激发单重态,如图3-1(b)所示。如果处于激发态的电子自旋方向发生改变,两个电子的自旋方向平行,自旋量子数都为+1/2,总自旋量子数S=1,电子的多重性2S+1=3,称为激发三重态,如图3-1(c)所示。为了便于理解,现将电子激发过程的三种状态列于表3-1中。

图3-1 π电子存在的三种状态
表3-1 π电子激发过程的三种状态

(2)产生荧光和磷光的原理过程
荧光和磷光的产生原理过程可用图3-2来描述。根据玻尔兹曼分布定律,分子在室温下基本上处于基态。当分子吸收了紫外-可见光后,分子的量子化能级则由基态S0跃迁到激发单重态的各个振动能级Si(如S1、S2等),但不能直接跃迁到激发三重态的各个振动能级Ti(根据自旋禁阻选律)。
如果用紫外-可见光连续照射待测物质,基态分子不断跃迁至激发态,基态分子应该越来越少,激发态分子越来越多,直至饱和,其紫外-可见光的吸收(吸光度)也应逐渐减小直至消失。而事实上物质仍然在连续地吸收紫外-可见光,即吸光度是恒定的,这说明处于激发态的分子必然有多种途径释放能量回到基态。一种途径是无辐射跃迁(如振动弛豫、外部能量转换),另一种途径是辐射跃迁(发射光子),这就是荧光。分子在基态的数量与在激发态的数量处于动态的可逆平衡过程中,其分布遵循玻尔兹曼定律。

激发态是不稳定状态,激发态分子存在的时间很短,约为10-15s数量级。由于分子间的碰撞或分子内晶格间的相互作用,在某一激发单重态的分子,以热能的形式失去少部分能量,从较高的量子化振动能级逐级下降到该激发态的最低的量子化振动能级,这个过程称为振动弛豫。发生振动弛豫的时间约为10-12s数量级。振动弛豫只在同一量子化能级内进行,属于无辐射跃迁。

图3-2 荧光与磷光产生示意图
A—紫外吸收;B—振动弛豫;C—内部能量转换;D—荧光发射;E—体系间跨越;F—磷光发射;G—内部能量转换;S0—基态(基线单重态)S1—第一激发单重态;S2—第二激发单重态;T1—第一激发三重态
当两个相邻激发单重态的电子能级非常接近,以至于下级的最高振动能级与上级的最低振动能级有重叠时,常发生电子由高能级以非辐射跃迁方式转移至低能级,这种非辐射跃迁过程称为内部能量转换。内转换是在同一体系内进行的,如电子能级在激发单重态![]() 与
与![]() 之间的转换,是单重态能级之间的转换;电子能级在激发三重态T2与T1之间的转换,是三重态能级之间的转换。
之间的转换,是单重态能级之间的转换;电子能级在激发三重态T2与T1之间的转换,是三重态能级之间的转换。
分子吸收不同波长的紫外-可见光能量后,分别跃迁到不同的激发单重态,如![]() ……,处于较高激发单重态中不同振动能级的分子,通过振动弛豫-内转换降到下一级单重态的不同振动能级,最后均到达第一激发单重态的最低振动能级。处于第一激发单重态的最低振动能级的电子,如果以辐射光量子的形式失去能量回到基态的不同振动能级,这种辐射的光量子就称为荧光。
……,处于较高激发单重态中不同振动能级的分子,通过振动弛豫-内转换降到下一级单重态的不同振动能级,最后均到达第一激发单重态的最低振动能级。处于第一激发单重态的最低振动能级的电子,如果以辐射光量子的形式失去能量回到基态的不同振动能级,这种辐射的光量子就称为荧光。
处于第一激发单重态的最低振动能级的电子,并不是全部都以辐射光量子途径释放能量回到基态的,因为待测分子处于溶液中,在激发态分子之间、分子与溶剂分子之间、分子与容器内壁及其它媒介之间,因产生相互碰撞而失去能量,常以热能的形式释放,这个过程称为外部能量转换。外部能量转换又称荧光猝灭,属于无辐射弛豫,这是一种释热平衡过程,所需时间在10-9~10-7s。外部能量转换发生在第一激发单重态或第一激发三重态的最低振动能级向基态的转换过程中,外部能量转换的存在使分子的荧光产率降低,荧光强度减弱。所以荧光测定时应该在尽可能低的环境温度下进行,并采用黏度较高的溶剂,以降低外部能量转换对荧光产率的影响。
当处于激发单重态的分子中若含有重原子(如碘、溴等),电子的自旋与轨道运动就会发生强偶合作用,电子的自旋方向发生反转,如果某一激发三重态的较高振动能级与该电子所处的激发单重态的最低振动能级重叠(量子化能级相当),电子经过自旋反转由激发单重态转移到激发三重态,此过程称为不同体系之间的跨越,简称体系间跨越。在溶液中存在氧分子等顺磁性物质也能增加体系间跨越的发生。体系间跨越会使荧光减弱。
经过各激发单重态至激发三重态的体系间跨越的分子,再经过振动弛豫和三重态里的内转换,最后降至三重态的最低振动能级,存活(延迟)一段时间,然后发射光辐射至基态的各振动能级,这种光辐射称为磷光。从紫外光照射到发射荧光的时间为10-8~10-14s,而发射磷光的时间更迟一些在照射后10-4~10s。分子在三重态的最低振动能级回到基态时,同样存在着外部能量转换,由于热运动的存在,待测分子之间、待测分子与溶剂分子之间都会产生相互碰撞,分子以热能的形式失去能量回到基态。所以在室温下溶液很少呈现磷光,发射磷光需要的环境温度比荧光要求更低,必须采用液氦在冷冻条件下激发才能检测到磷光。正因为如此,磷光法的应用不如荧光法普及。
2.激发光谱与发射光谱
分子荧光和磷光产生首先是分子受到激发,然后才产生光辐射。即分子受紫外-可见光的照射后获得能量,其量子化能级由基态跃迁到激发态,这个过程称为激发,因激发过程而吸收的紫外-可见吸收光谱称为分子的激发光谱,这是产生荧光和磷光的必备条件。处于激发态(单重态或三重态)的分子发射光子释放能量回到基态所产生的光谱称为发射光谱。所以荧光和磷光属于分子发射光谱。分子的激发光谱与发射光谱是因与果的关系,激发光谱是条件,发射光谱是结果。
注意分子的吸收光谱与激发光谱和发射光谱的图谱表达方式的差异。紫外-可见吸收光谱是以分子吸收的紫外-可见光波长λ为横坐标、以吸光度A为纵坐标绘制的图谱;分子的激发光谱是以激发光波长λex为横坐标、荧光或磷光的发光强度F为纵坐标绘制的图谱;分子的发射光谱是以发射的荧光或磷光波长λem为横坐标、荧光或磷光的光强度F为纵坐标绘制的图谱。激发光谱与发射光谱可以通过荧光光度计实验同时获得。
分子的激发光谱和发射光谱的检测原理如图3-3所示。光源发出的紫外-可见光通过第一单色器,获得波长为λex、光强度为I0的单色激发光,经过吸收池时被待测溶液吸收部分光量子,透射光的光强度降低为I。分子获得激发光λex的能量后由基态跃迁到激发态,然后立体全方位地发射荧光或磷光(释放能量)回到基态,为了避开透射光的干扰,接收(或采集)发射光(荧光或磷光)的第二单色器一般设在以吸收池为坐标原点,与激发光传播方向垂直的位置上。

图3-3 获得激发光谱和发射光谱示意图
如果固定荧光波长λem不变,改变第一单色器(对激发光波长λex进行扫描),从而获得分子的F-λex激发光谱。如果固定激发光波长λex,改变第二单色器(对发射光波长进行扫描),即可获得F-λem发射光谱。荧光物质的最大激发光波长和最大荧光波长是鉴定物质结构的依据之一,也是定量测定时最灵敏的光谱条件。
图3-4是硫酸奎宁(结构如下)的激发光谱与发射光谱示意图。

图3-4 硫酸奎宁的激发光谱与发射光谱示意图
从实验测得荧光物质的激发光谱与紫外吸收光谱形状相似。这是因为荧光物质吸收了这种波长的紫外光,才能发出荧光。吸收越强则发射的荧光越强。区别在于紫外吸收光谱测定的是对紫外光的吸光度,而荧光激发光谱测定的是发射的光强度,故两者的图谱不能重叠。
从图3-4可以看到:硫酸奎宁的激发光谱(吸收光谱)有两个峰,而其荧光光谱仅有一个峰。这是因为物质分子可以从基态(S0)跃迁至第一电子激发单重态(S1)或第二电子激发单重态(S2),因此激发光谱有两个峰。但不论分子的量子化能级跃迁到哪一级激发单重态,都会经过振动弛豫、内部能量转换的非辐射跃迁,最终下降到第一激发单重态的最低振动能级(S1的V0),最后以辐射跃迁(发射光量子,即荧光)的形式释放能量而回到基态的不同振动能级。对于某个分子来说,其基态与第一激发单重态的量子化能级差ΔE是唯一确定的,依据ΔE=hν可知,荧光的频率或波长是确定的,所以发射光谱(荧光光谱)只有一个峰。即当荧光物质的激发光谱有几个峰时,无论采用哪一个峰的波长的光作为激发光,荧光的发生总是从第一激发单重态(S1)的最低振动能级开始的,荧光光谱只能出现一个峰,所以荧光光谱的形状与激发光波长无关。
蒽的激发光谱与荧光光谱如图3-5所示。从图上可见,蒽的激发光谱有两个峰,a峰是由分子基态跃迁至第二激发单重态而形成的;b峰是由分子基态跃迁至第一激发单重态而形成的。b峰在高分辨率的荧光图谱上还可以观察到b0~b4一系列小峰,它们是由于第一激发单重态的不同振动能级V0~V4引起的。如图3-5所示,b0峰相当于b0跃迁线,b1峰相当于b1跃迁线,以此类推。各小峰间波长的递减值Δλ与振动能级差ΔEi(图3-6)有关,各小峰的强度与跃迁概率有关(b1跃迁概率最大,b0次之,b2、b3、b4依次递减)。蒽的荧光光谱同样包含c0~c4的一组小峰,它们由于分子从第一激发单重态的最低振动能级跃迁至电子基态的各个不同振动能级而形成,c0峰相当于c0跃迁线,c1峰相当于c1跃迁线,以此类推。各小峰间波长的递增值Δλ与振动能级差ΔEi有关。由于基态的振动能级分布与激发态相似,故b1峰与c1峰、b2峰与c2峰、b3峰与c3峰、b4峰与c4峰都以λ(b0)为中心基本对称。再加上c0~c4峰的强度也与跃迁概率有关(c1跃迁概率最大,c0次之,c2、c3、c4依次递减),因此使激发光谱和荧光光谱呈镜像对称现象。

图3-5 蒽的激发光谱和荧光光谱

图3-6 蒽的能级跃迁情况示意图
3.分子结构与荧光的关系
我们知道,在紫外-可见光的辐射下,并不是所有物质分子都能产生荧光,只有某些特定结构的分子才能产生荧光或磷光,这就是荧光与物质分子结构的紧密相关性和高选择性。
(1)产生荧光的必要条件
能够发射荧光的物质必须同时具备两个条件:①物质分子必须有强的紫外-可见吸收。分子结构中有π→π*跃迁或n→π*跃迁的物质都有紫外-可见吸收,但n→π*跃迁引起的R带是一个弱吸收带,电子跃迁概率小,由此引起的荧光极微弱,实际上只有分子中存在足够共轭双键的π→π*跃迁,也就是K带强吸收时,才能产生荧光。②物质分子必须有一定的荧光效率。荧光效率是指物质发射荧光的量子数和所吸收的激发光量子数的比值,也称荧光量子产率,用φf表示,φf的值在0~1。

例如,荧光素钠和荧光素在水中,蒽和菲在乙醇中的荧光效率如下。(https://www.xing528.com)

如果物质虽然有强的紫外-可见吸收,但所吸收的能量都以无辐射跃迁形式释放,内部猝灭与外部猝灭速度很快,致使荧光效率低下,也是没有荧光产生的。
(2)分子结构与荧光
如上所述,荧光物质分子必须有强的紫外吸收和高的荧光效率。长共轭分子具有π→π*跃迁的K带紫外吸收,刚体平面结构分子具有较高的荧光效率。在共轭体系上的取代基对荧光光谱和荧光强度也有很大影响。
长共轭结构 绝大多数能产生荧光的物质含有芳香环或杂环。因为芳香环或杂环分子具有长共轭的π→π*跃迁。当π电子共轭越长,λex和λem都长移,荧光强度(荧光效率)也增大,如下面前三个化合物的共轭结构与荧光的关系。

除了芳香环外,含有长共轭双键的脂肪烃也可能有荧光,但这类化合物的数量不多,维生素A是能发生荧光的脂肪烃之一,其激发光和荧光波长见上面最后一个化合物。
刚性平面结构 在同样的长共轭分子中,分子的刚性和共平面性越大,荧光效率φf越大,并且荧光波长产生长移。例如联苯和芴,在相同的测定条件下的荧光效率φf分别为0.2和1.0,二者的结构差异在于:联苯的两个苯环中间以单键相联,可以自由旋转,两个苯环并不一定总在同一平面上;而芴的两个苯环中间以五元环相联,三个环构成一个大平面而不能旋转,刚性平面性都很好,所以芴的φf大大增加。
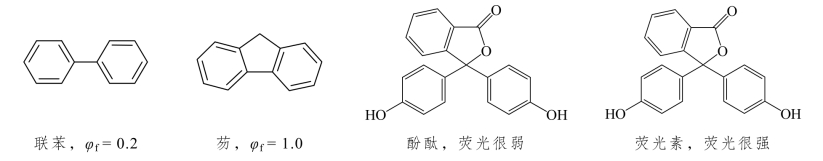
同样情况还有酚酞和荧光素,它们分子中的共轭双键长度相同,但荧光素分子中多一个氧桥,使分子中的三个环成为一个大平面,分子的刚性平面性增加,π电子的共轭程度增加,因而荧光素有强烈的荧光,而酚酞的荧光却很微弱。
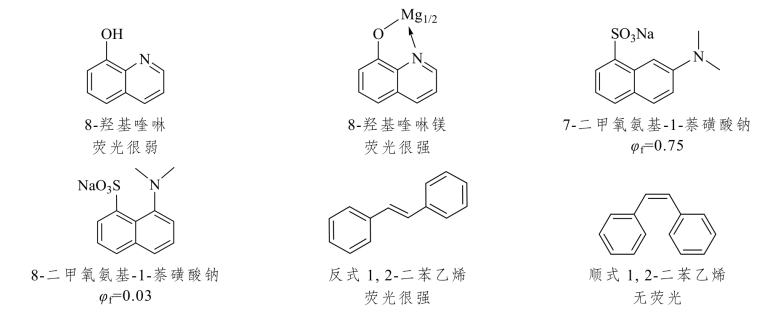
本来不产生荧光或产生微弱荧光的物质,一旦与金属离子形成配合物后,如果刚性和平面性增强,则可能产生荧光或荧光大大增强。例如,8-羟基喹啉是弱荧光物质,与mg2+、Al3+形成配合物后,荧光强度就大大增加。
相反,如果原来结构中共平面性较好,但分子中的取代基较大、位置紧邻,由于位阻的原因使分子结构变形共平面性下降,则荧光减弱。例如,7-二甲氧氨基-1-萘磺酸盐比8-二甲氧氨基-1-萘磺酸盐的荧光效率大得多,是因为后者两个取代基紧邻而有位阻效应,使分子结构产生变形,两个环不能共平面,因而使荧光大大减弱。对于顺反异构体,顺式分子的两个基团在同一侧,由于位阻原因使分子不能共平面而没有荧光。
取代基的影响 荧光分子上的各种取代基对其荧光效率和光谱都产生很大的影响。取代基可分为三类,第一类取代基能增强分子的π电子共轭程度,常使荧光效率提高,荧光波长长移;第二类基团减弱分子的π电子共轭性,使荧光减弱甚至熄灭;第三类取代基对π电子共轭体系作用较小,对荧光的影响不明显。三类基团的影响参见表3-2。
表3-2 三类取代基对荧光效率的影响

4.影响荧光的外界因素
分子所处的外界环境因素对荧光效率的影响是很大的,这些因素包括温度、溶剂、pH、荧光熄灭剂、散射光的干扰等。
(1)温度的影响
当温度升高时,分子的热运动速率加快,分子间碰撞的概率增加,使无辐射跃迁增加,从而降低了荧光效率。因此,物质的荧光强度随温度的升高而降低。例如,荧光素钠的乙醇溶液,在-80℃时φf可达到1,每升高10℃,φf降低3%。荧光测定时,环境温度尽量在低温的情况下比较有利。
(2)溶剂的影响
同一种荧光物质在不同的溶剂中,其荧光光谱的位置和荧光强度都是有差异的。一般情况下,荧光波长随着溶剂极性的增大而长移,荧光强度也增加。因为在极性溶剂中,π→π*跃迁所需要的能量差ΔE小,而且跃迁概率增加,使紫外吸收的波长和荧光波长均向长移,强度也增加。
当溶剂黏度减小时,分子所受束缚减弱碰撞机会增加,使无辐射跃迁增加而荧光减弱。故荧光强度随溶剂黏度的增大而增大。含有重原子的溶剂,如碘乙烷、四溴化碳等,也可使化合物荧光减弱。如果溶剂与溶质分子能形成稳定氢键,处于第一激发单重态的最低振动能级(S1的V0)的分子将减少,从而使荧光减弱。
(3)pH的影响
当荧光物质本身是有机弱酸或弱碱时,溶液的pH对该物质的荧光强度有较大的影响。这是因为有机弱酸或弱碱在不同pH条件下发生解离平衡移动,因而荧光强度也有差异。例如,苯胺在不同pH条件下的解离平衡也产生荧光情况如下。

(4)荧光熄灭剂的影响
荧光熄灭又称荧光猝灭,是指荧光物质分子与溶剂分子或溶质分子的相互作用引起的荧光强度降低的现象,这时荧光强度与浓度不呈线性关系。引起荧光熄灭的物质称为荧光熄灭剂,如卤素离子、重金属离子、氧分子,以及硝基化合物、重氧化合物、羰基和羧基化合物等均为常见的熄灭剂。荧光熄灭的形式很多,例如:因荧光物质和熄灭剂分子碰撞而损失能量;荧光分子与熄灭剂分子生成不发光的配合物;在荧光物质中引入溴或碘后,易发生体系间跨越而转变至激发三重态;溶解样的存在使荧光物质被氧化,或由于氧分子的顺磁性促进了体系间跨越,使激发单重态荧光分子转成三重态。
荧光熄灭剂在荧光分析中会产生误差。如果一个荧光物质在加入熄灭剂后,荧光强度的减小和荧光熄灭剂的浓度呈线性关系,则可以利用这一性质测定熄灭剂的含量,这种方法称为荧光熄灭法。例如,利用氧分子对硼酸根-二苯乙醇酮配合物的荧光熄灭效应,可进行微量氧的测定。
在荧光物质浓度>5g/L时,由于荧光分子间碰撞概率增加,也有荧光熄灭现象,而且浓度越高荧光熄灭越严重,所以应采用低浓度方法测定。
(5)散射光的干扰
把一束平行光照射到盛有样品溶液的吸收池时,一部分光会被溶液吸收,另一部分则透过溶液,还有一小部分光由于光子和物质分子相碰撞,其运动方向发生改变而向不同角度散射,这种改变了传播方向的光称为散射光。
光子和物质分子发生弹性碰撞时,不发生能量交换,仅是运动方向发生改变,这种散射光称为瑞利光,其波长和入射光相同。
光子和物质分子发生非弹性碰撞时,不仅光子的运动方向发生改变,还与物质分子之间发生能量交换,有可能使光子的能量减小或增加,这种既改变运动方向又改变光子能量的散射光称为拉曼光。
当光子将部分能量传给物质分子时,光子能量降低,散射光波长变长,这种拉曼光对荧光测定有干扰;当光子从物质分子得到能量时,光子能量升高,散射光波长变短,这种拉曼光对荧光测定无影响。当拉曼光与荧光波长接近时,对荧光测定影响较大,必须采取措施予以消除,方法是采用适当的激发光波长。
例如,硫酸奎宁的荧光测定,无论选择320nm或350nm为激发光波长,荧光峰总是在448nm,如图3-7所示。将0.05mol/L的H2SO4溶液(空白溶剂)分别在320nm及350nm激发光照射下测定荧光光谱(实际上只有散射光),当激发光波长为320nm时,瑞利光波长320nm,拉曼光波长360nm;当激发光波长为350nm时,瑞利光波长320nm,拉曼光波长400nm。显然,采用350nm产生的400nm拉曼光,对硫酸奎宁的448nm荧光峰是有影响。如果改用320nm激发光则避免了这种影响。

图3-7 硫酸奎宁与硫酸空白在不同波长激发光下的荧光和散射光谱
水、乙醇、环己烷、四氯化碳和氯仿5种常用溶剂在不同波长激发光照射下的拉曼光波长如表3-3所示,可供选择激发光波长时参考。
表3-3 5种常用溶剂在不同激发光波长下的拉曼光波长

从表中可见,四氯化碳的拉曼光与激发光波长很接近,几乎不干扰荧光测定,是优选溶剂。而水、乙醇和环己烷的拉曼光波长较长,使用时必须注意。
(6)激发光源的影响
某些物质的稀溶液在激发光的照射下很容易分解,使荧光强度持续下降,为此在测定时应迅速完成,测定后立即切断光路。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




