大多数细菌通过无性二分裂方式进行繁殖,酵母菌主要以出芽繁殖为主,繁殖速度很快。以大肠杆菌为例,在适宜条件下,每20 分钟分裂一次,如果始终保持该繁殖速度,一个细胞在48 小时后,其子代总质量可达到2.2 ×1031 g,约为地球质量的3 680 倍。 然而,实际情况并非如此,随着营养物质的消耗,有害代谢产物的积累,外界环境条件的改变,细菌生长到一定阶段就会停止生长。 那么,微生物的生长规律是怎样的呢? 由于微生物个体微小,对于单个细胞微生物来说,生长和繁殖是两个不同的概念,但对于微生物群体来说,多以细胞数目的增加作为生长指标,在科研及生产实践中通常研究的是群体微生物的生长规律。
1)微生物的生长曲线
少量的具有活力的微生物置于有充足养分供应的适宜环境中会大量繁殖,这种繁殖可用细胞个体数目的变化或者生物量的变化来表示。 如以培养时间为横坐标,以菌数或生物量(或其对数)为纵坐标,可以绘制一条曲线,这就是生长曲线(growth curve)。
根据生长曲线的特点,可将生长粗略地分为4 个时期,即停滞期、指数期、稳定期和衰亡期(图2.2)。
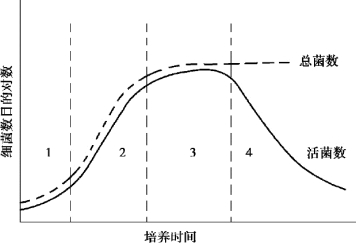
图2.2 单细胞微生物的生长曲线
1—停滞期;2—指数期;3—稳定期;4—衰亡期
①停滞期(lag phase)的特点是细胞数目不增加。 微生物遇到新的基质或进入新环境以后,需要有一个调整阶段,需要合成一些RNA、核糖体和酶以适应新环境。 菌体数目虽不增加,但细胞体积会增大,原生质变得均匀一致,贮藏物质消失。
②指数期(log phase)的特点是细胞数目以几何级数快速增加。 这个时期细胞的化学组成、形态和生理特征整齐一致,细胞健壮,代谢活力强,合成作用和分解作用都很强烈。
③稳定期(stationary phase) 的特点是细胞数目维持恒定,细胞增殖的数目和细胞死亡的数目趋于相等。 指数期以后细胞消耗了大量营养物,并积累了一些抑制性代谢产物如有机酸等,使群体生长停顿下来。 这时细胞开始积累贮藏物质,如糖原、脂肪球等。 大多数芽孢菌开始形成芽孢。
④衰亡期(decline phase)的特点是个体死亡的速度超过繁殖速度。 细胞呈衰老状况,形态和体积差别很大,有多种形态(畸形和退化型),胞内颗粒更加明显,并有自溶现象(autolysis)。
2)微生物的同步培养
由于微生物个体极其微小,在微生物的研究和应用中,一般研究的是群体微生物的生长繁殖规律。 但在微生物群体生长中,其中的每个个体可能分别处于生长的不同阶段,它们的生长、生理与代谢活性等特性不一致,表现出生长与分裂不同步的现象。
利用实验室技术控制细胞的生长,使它们处于同一生长阶段,所有的细胞都同时分裂,这种生长方式称为同步生长。 获得同步培养的方法很多,最常用的有机械法(离心沉降分离法、过滤分离法、硝酸纤维素滤膜法)和环境条件控制法(温度控制、培养基成分控制等)。
(1)机械法
机械法又称选择法,是指根据微生物细胞在不同生长阶段的细胞体积与质量或根据它们同某种材料结合能力的不同设计出来的方法,其中常用的方法有以下3 种。
①离心沉降分离法。 处于不同生长阶段的细胞,其个体大小不同,将它们悬浮在蔗糖或葡萄糖的不同梯度溶液里,通过密度梯度离心将不同大小的细胞分离成不同的细胞带,而每一细胞带的细胞大小大致相同,分别将它们取出培养,便可获得同步培养物。
②过滤分离法。 应用孔径大小不同的微孔滤膜,可将大小不同的细胞分开。 例如选用适宜孔径的微孔滤膜,将不同步的大肠杆菌群体过滤,由于刚分裂的幼龄菌体较小,能够通过滤孔,其余菌体都留在滤膜上面,将滤液中的幼龄细胞进行培养,就可获得同步培养物。
③硝酸纤维素滤膜法。 将菌液通过硝酸纤维素滤膜,由于细菌与滤膜带有不同电荷,所以不同生长阶段的细菌均能附着于膜上。 翻转滤膜再用新鲜培养液滤过培养,附着于滤膜上的细菌进行分裂,分裂后的子细胞不与膜直接接触,由于菌体本身的质量,加之它所附着的培养液的质量,便下落到收集器内。 收集器在短时间内收集的细菌处于同一分裂阶段,用这种细菌接种培养,能得到同步培养物。
(2)环境条件控制技术
环境条件控制技术是指根据微生物生长对环境因子的不同要求设计的一类获得同步培养的方法。
①温度。 将微生物的培养温度控制在接近最适宜的温度条件下一段时间,它们将缓慢地进行新陈代谢,但又不进行分裂。 换句话说,使细胞的生长在分裂前不久的阶段稍微受到抑制,然后将培养温度提高或降低到最适生长温度,大多数细胞就会同步分裂。 人们利用这种现象已设计出多种细菌和原生动物的同步培养法。
②培养基成分控制。 培养基成分控制即控制营养物的浓度或培养基的组成以达到同步生长。 例如限制碳源或其他营养物,使细胞只能进行一次分裂而不能继续生长,从而获得了刚分裂的细胞群体,再转入适宜的培养基中,它们便进入了同步生长。 对营养缺陷型菌株,同样可以通过控制它所缺乏的某种营养物质而达到同步化。 例如大肠杆菌胸腺嘧啶缺陷型菌株,先在不含胸腺嘧啶的培养基内培养一段时间,所有细胞分裂后,由于缺乏胸腺嘧啶,新的DNA 无法合成而停留在DNA 复制前期,随后在培养基中加入适量的胸腺嘧啶,于是所有的细胞都同步生长。(https://www.xing528.com)
诱导同步生长的环境条件多种多样。 不论哪种诱导因子都必须具有以下特性:不影响微生物生长,但可特异性地抑制细胞分裂,当移去(或消除)该抑制条件后,微生物又可立即同时出现分裂。 研究同步生长诱导物的作用,将有助于揭示微生物细胞分裂的机制。
3)微生物的连续培养
连续培养(continous culture)是在微生物的整个培养期间,通过一定的方式使微生物以恒定的比生长速率生长下去的一种培养方法。 根据生长曲线,营养物消耗和代谢产物的积累是导致微生物生长停止的主要原因。 因此在微生物培养过程中,不断补充营养物质和以同样的速率移出培养物是实现微生物连续培养的基本原则。 控制连续培养的方法主要有两类:恒化连续培养与恒浊连续培养。
(1)恒化连续培养
控制恒定的流速,使由于细菌生长而耗去的营养及时得到补充,培养室中营养物浓度基本恒定,从而保持细菌的恒定生长速率,这种方法称为恒化连续培养,又称为恒组成连续培养。
恒化连续培养的培养基成分中,必须将某种必需的营养物质控制在较低的浓度,以作为限制因子,而其他营养物均为过量,这样,细菌的生长速率将取决于限制因子的浓度。 随着细菌的生长,限制因子的浓度降低,致使细菌生长速率受到限制,但同时保持限制因子的恒定流速,不断予以补充,就能使细菌保持恒定的生长速率。 用不同浓度的限制性营养物进行恒化连续培养,可以得到不同生长速率的培养物。 能作为恒化连续培养限制因子的物质很多,这些物质必须是机体生长所必需的,在一定浓度范围内能决定该机体的生长速率。 常用的限制性营养物质有作为氮源的氨、氨基酸,作为碳源的葡萄糖、麦芽糖、乳酸,以及生长因子、无机盐等。
恒化连续培养法多用于微生物学研究工作中。 从遗传学角度来讲,它允许做长时间的细菌培养而能从中分离出不同的变种;从生理学方面看,能帮助我们观察细菌在不同生活条件下的变化,尤其是DNA、RNA 及蛋白质合成的变化,同时它也是研究自然条件下微生物生态体系比较理想的试验模型。 因为生长在自然界的微生物一般都处于低营养浓度条件下,生长也较慢。 而恒化连续培养正好可通过调节控制系统来维持培养基成分的低营养浓度,使之与自然条件相类似。
(2)恒浊连续培养
不断调节流速而使细菌培养液浊度保持恒定的连续培养方法称为恒浊连续培养。 在恒浊连续培养中装有浊度计,借光电池检测培养室中的浊度(即菌液浓度),并根据光电效应产生的电信号强弱变化,自动调节新鲜培养基流入和原有培养物流出速度。 当培养室中浊度超过预期数值时,流速加快,浊度降低,反之流速减慢,浊度增加,以此来维持培养物的某一恒定浊度。 如果所用培养基中有过量的必需营养物,就可使菌体维持最高的生长速率。 恒浊连续培养中,细菌生长速率不仅受流速的控制,也与菌种种类、培养基成分及培养条件有关。
恒浊连续培养可以不断提供具有一定生理状态的细胞,得到以最高生长速率进行生长的培养物。 在微生物工作中,为了获得大量菌体以及与菌体相平行的代谢产物,使用此法具有较好的经济效益。
连续培养法用于工业发酵时称为连续发酵(continuous fermentation)。 我国已将连续发酵用于丙酮-丁醇的发酵生产中,缩短了发酵周期,效果良好。 在国外应用更为广泛。 连续发酵的最大优点是取消了分批发酵中各批之间的时间间隔,从而缩短发酵周期,提高设备利用率。另外,连续发酵便于自动控制,降低动力消耗及体力劳动强度,产品也较均一。 但连续发酵中杂菌污染和菌种退化问题仍较突出。 代谢产物与机体生长不平行的发酵类型的连续培养技术有待完善。
4)微生物的厌氧培养
在微生物世界中,厌氧菌的种类相对较少,绝大多数种类都是耗氧菌或兼性厌氧菌。 如今已发现越来越多的厌氧菌,如巴氏梭菌、丙酮丁酸梭菌、双歧杆菌等。 专性厌氧菌的培养常采用物理或化学的方法。
(1)厌氧培养基
专性厌氧菌只能在很低氧化还原电位的培养基中生长,因此在配置培养基时,除满足微生物的营养需求外,还要加入氧化还原指示剂和还原剂,如半胱氨酸、硫乙醇酸盐、Na2S 或维生素C 等。
(2)厌氧培养的容器和技术
①高层琼脂柱。 将含有还原剂的固体或半固体培养基装入试管中,经灭菌后,除表层尚有一些溶解氧外,越是深层,其氧化还原势越低,故有利于厌氧菌生长。
②烛罐法。 将培养物放在密闭的容器中,点燃蜡烛,当氧气耗尽、火焰熄灭,有7%的CO2存留在空气中。 本法较粗糙,仅供在没有厌氧培养条件下使用。
③厌氧培养皿。 用于厌氧培养的培养皿有几种设计。 有的是利用特制皿盖创造一个狭窄空间,再加上还原性培养基的配合使用而达到厌氧培养的目的。
④亨盖特滚管技术。 亨盖特滚管技术由美国生物学家R. E. Hungate 于1950 年设计。 这是生物学发展历史中的一项具有划时代意义的创造,由此推动了严格厌氧菌(如瘤胃微生物区系和产甲烷菌)的分离和研究。 其主要原理是利用铜柱除氧制备高纯氮,并用高纯氮排出小环境中的空气,使培养厌氧菌的工作始终在无氧环境下完成,严格保证厌氧菌的存活。
⑤厌氧培养箱。 通过抽取厌氧培养箱或罐中的氧气,充入其他气体如N2、H2 或CO2 等,从而形成厌氧环境。 在保证箱内厌氧环境的前提下,为了使培养材料、培养物更方便进出箱体,开发了厌氧手套箱。 这种培养箱的箱体上有两只塑料手套,工作人员可以通过手套进入箱内进行操作。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




