第一节 直肠癌
一、直肠的应用解剖
直肠位于盆腔内,长为10~14cm,与乙状结肠相接,起于第3骶椎水平,向下延续,终止于盆膈,以齿状线为界而与肛管相连。直肠下段肠腔膨大,称为直肠壶腹。壶腹内常有2~3个由黏膜及环行肌构成的半月形皱襞,称为直肠横襞或Houston瓣,其中位于壶腹部上段且位置相对固定的一个皱襞距肛门约7cm,可作为直肠镜检的定位标志。
直肠来源于后肠末端的泄殖腔后份,上皮起源于内胚层,为单层柱状上皮,因此直肠癌多为腺癌。肛管来源于原肛,上皮起源于外胚层,为复层扁平上皮,常发生鳞癌、基底细胞癌、黑素瘤等。
(一)直肠的血供
直肠上动脉为肠系膜下动脉的终末支,经乙状结肠系膜两层之间下降,在直肠上端后方分成两支侧支,沿直肠两侧下行,分支至直肠,并在直肠表面及壁内与直肠下动脉的分支吻合;直肠下动脉由髂内动脉或阴部内动脉分支,由直肠侧韧带进入直肠,主要供应直肠下段血供。齿状线以下为肛管提供血供的是肛门动脉,该动脉为阴部动脉的终末支。
(二)直肠的淋巴引流
分为上下两个引流区域。齿状线以上的直肠淋巴为上部引流区,有3个引流方向:①向上直肠上段淋巴可沿直肠上动脉上行,可达肠系膜下动脉淋巴结,甚至达腹主动脉旁淋巴结;②向两侧可经直肠下动脉抵达骶前淋巴结;③向下可至直肠旁淋巴结,继而抵达髂内淋巴结。齿状线以下的淋巴引流为下部引流区,主要经会阴引流至双侧腹股沟淋巴结。因上下两个引流区间存在吻合支,故直肠癌也可出现“跳跃性”淋巴结转移,甚至“逆向”淋巴结转移。
二、直肠对放疗的反应和耐受性
根据临床治疗的结果,人们已经认为直肠癌是中度放射敏感的肿瘤。直肠周围器官受射线的影响是限制高剂量放疗治疗直肠癌的瓶颈。直肠放疗TD5/5剂量6 000cGy,TD50/5剂量8 000cGy,放疗对直肠的损伤主要是肠黏膜溃疡、缩窄。临床治疗剂量常为DT6 000cGy,随着三维适形放疗技术的进步,可以针对直肠肿瘤局部加量至DT6 400cGy左右。
小肠黏膜增殖快,对放射较敏感。常规分割剂量照射40~50Gy后,在1~2年以后可有1%~5%的患者出现小肠溃疡、坏死、穿孔、出血以及肠梗阻,照射65Gy后,并发症发生率可上升至25%~50%。直肠癌术后,盆腔解剖结构破坏,进入盆腔的小肠容积增加,放疗引起的急性反应如恶心、呕吐、腹泻、便血等发生率增加,严重时可导致治疗中断,是限制直肠癌放疗的主要因素。术前放疗引起的急性毒性反应发生率则明显下降,这是由于直肠解剖结构未被破坏,小肠进入盆腔部分少。放疗出现的反应可采用止吐药、解痉药以及止泄药对症处理相应的症状常可缓解,严重时需停止放疗,待肠道黏膜增殖恢复正常后再继续放疗。膀胱对射线耐受剂量较高,TD5/5剂量为6 000cGy,TD50/5剂量为8 000cGy。放疗6 000cGy以下常引起膀胱刺激症状,对症处理可缓解。超过膀胱的耐受量放疗可出现膀胱挛缩及血尿。故直肠癌放疗中,后期缩野应尽可能减少膀胱受累容积。输尿管及盆腔骨骼辐射耐受性好,很少发生放疗损伤导致的临床症状。
三、直肠癌的流行病学
(一)直肠癌的发病情况
结、直肠癌的发病率在全世界各个国家和地区之间都存在差异。发达国家地区如美国、欧洲、大洋洲等地区的直肠癌发病率一直较高,可达20~34/10万,而不发达国家和贫穷地区,直肠癌发病率较低,但随着社会工业化进程的发展,生活环境污染加重及饮食结构的变化,这些地区的结、直肠癌发病率也有所升高。2005年,美国结、直肠癌新发病者约145 290例,死亡病例约为56 290例,成为美国第三大威胁人类健康的恶性肿瘤。目前,在全球范围内结、直肠癌已成为常见恶性肿瘤的第4位,发病率每年增长2%。据估计每年新发病1 023 000例,死亡病例达到529 000例。
近年来,随着我国社会经济的增长和工业化程度的提高、环境污染以及饮食结构变化,大中城市的结、直肠癌发病率呈明显上升趋势,已成为第3位的恶性肿瘤,在消化道肿瘤中仅次于胃癌而列第2位。20世纪60年代,我国结、直肠癌发生率仅为6/10万,至90年代末猛增至24/10万,上海市结、直肠癌的发病率每年增加4.2%。目前,男性和女性的结、直肠癌发病率分别为37.2/10万和35.5/10万。我国结、直肠癌发病率增高除与逐渐步入老龄化社会有关外,工业污染、膳食因素以及不良生活习惯也使年轻人中的发病率明显增高。
(二)直肠癌的病因学
直肠癌的发病是在致癌因素长期刺激下的漫长过程。在致癌因素的作用下,肠道黏膜上皮细胞的某个或多个基因结构和功能发生改变,这些变化如随着时间的推移积累下来,最后导致单个细胞恶变,在逃避免疫监视的情况下发展成为具有侵袭性表型的恶性肿瘤,最后危及生命。目前已经公认的直肠癌病因有如下几个:
1.饮食习惯及生活方式 高蛋白、高脂肪、高糖、低纤维素是导致结、直肠癌发生的重要因素。因为这类食物的代谢产物通过肠道的速度缓慢,代谢废物中致癌物质与肠黏膜接触时间增加,长期按照这类饮食习惯生活,就形成致癌物质对肠黏膜的长期刺激作用,增加了黏膜细胞癌变的机会。亚洲本土华人直肠癌发生率较低,而移民到西方的华人后裔直肠癌的发生率明显升高,并与西方本土人群相接近。在素食为主的人群中,结、直肠癌的发生率明显低于普通人群。
2.癌前病变 直肠腺瘤、溃疡性结肠炎和克隆病的患者,发生直肠癌的比例明显高于其他人群,如克隆病患者中发生癌变的比率要比正常人高7~10倍。
3.遗传因素 具有家族性腺瘤型息肉病,以及遗传性非息肉病性结、直肠癌家族史的人群是直肠癌发生的高危人群。
四、直肠癌的转移播散途径
直肠癌主要有4种转移形式:
(一)直接浸润
当肿瘤细胞浸润生长至黏膜肌层以下时,可沿着黏膜下层、肌层与浆膜下的间隙向远、近端蔓延生长。其浸润生长的距离对外科手术具有重要意义,术中必须距肿瘤边缘一定的安全距离切断肠管才能保证断端无癌残留。以往认为肿瘤远端的安全距离为5cm,但随着对直肠生理和病理学的认识,已经认为2cm作为安全距离已经足够。肿瘤浸润生长穿透浆膜后,可侵及肠周的组织和器官,如膀胱、前列腺、精囊腺、子宫、阴道、输尿管、盆壁以及骶尾部血管和神经丛。如果肿瘤浸润粘连紧密,常导致不能完整切除肿瘤,甚至使医生放弃手术切除。
(二)种植转移
直肠癌浸润生长侵透浆膜层后,部分肿瘤细胞可以从浆膜表面脱落种植于腹腔壁层腹膜或盆壁。Smith等研究发现,26%的直肠癌盆腔冲洗液中可以发现癌细胞。直肠癌的发生以低位直肠癌为主,肿瘤表面无腹膜覆盖,发生腹膜种植转移比较少见。外科手术如不遵循无瘤术原则,操作粗暴、挤压肿瘤、不保护肿瘤侵袭的浆膜或术中出血较多均可增加肿瘤细胞种植的机会,从而导致术后局部复发率增加。
(三)淋巴转移
肿瘤细胞局限于黏膜层时,由于黏膜层中无淋巴引流,所以发生淋巴转移的概率微乎其微,仅7%左右。T1~2的直肠癌患者5年生存率可达到90%。这部分患者可行局部黏膜切除术,术后生活质量不受影响。如肿瘤浸润至肌层或侵透浆膜甚至浸润肠周器官,则发生淋巴转移的机会明显增加。有报道,当肿瘤未侵透肠壁肌层时,有21.8%发生淋巴结转移;当肿瘤侵及浆膜或浸润至肠周组织时,有53%出现淋巴结转移,并且淋巴转移发生率的高低与直肠癌的病理类型和分化程度关系密切。Dukes曾报道,高、中、低分化癌的淋巴结转移率分别为30%、47.1%和81.3%。淋巴转移是影响直肠癌预后的重要因素。
(四)血行转移
血行转移是直肠癌最常见的转移方式。直肠血供丰富,肿瘤细胞浸润至黏膜下血管或肠壁外静脉,可导致肿瘤细胞进入血液循环的机会增加。Talbot曾报道,365例侵犯静脉的直肠癌患者中肝转移发生率为35.1%,而未侵犯静脉的338例患者中仅有14.2%发生肝转移。常见远处血行转移的部位为肝、肺血运丰富的器官,其次是骨、脑等器官,转移率分别为36.5%、34.6%、19.2%和3.9%。远处转移的直肠癌患者预后极差。肿瘤位于直肠的位置越高,发生肝转移的概率也越大,这是因为直肠的上段静脉汇入肠系膜下静脉,最后进入门静脉至肝脏。
五、临床表现及诊断
早期直肠癌临床症状不明显,常为人们所忽视,因此丧失了治疗的最好时机,患者就诊时常为中晚期。进展期直肠癌常以排便性状改变为主要症状。便血是直肠癌最常见的临床表现,约70%的患者可伴有该症状,以便中混有鲜血或棕红色便为多见。另外,便条变细、扁平、排便困难、便秘也是常见症状。肿瘤侵及肠周器官和组织可引起腰骶部酸痛、坠胀感,侵及神经丛可引起会阴部疼痛、里急后重感。侵及膀胱或输尿管,可出现膀胱刺激、血尿等症状。肿瘤细胞可种植于膀胱直肠窝或子宫直肠窝,女性患者可出现阴道分泌物增加或流血。部分患者可出现腹股沟区肿大淋巴结,甚至出现左锁骨上窝淋巴结的远处转移。
对于因排便性状和习惯改变,以及伴有腹痛、里急后重、肛门坠胀等泌尿生殖膈症状就诊的患者,均应常规行大便隐血试验、直肠指诊检查,直肠指诊可结合双合诊判断盆底状况。可疑患者应进一步行纤维结肠镜或钡剂灌肠检查。纤维结肠镜确诊率可高达90%,并且可以直接观察肿瘤部位、形态和大小,初步判断浸润范围,并判断预后。对于病理学或形态学确诊直肠癌的患者,应进一步行CT或MRI,以及腔内超声,准确判断肿瘤局部浸润范围和盆腔淋巴结状况,并行胸片、腹部B超、头部CT等检查确定是否出现远处转移,以明确肿瘤分期,指导选择治疗方案。对于局部晚期患者,建议行全身PET检查。如无远处转移,可针对此类患者行新辅助放、化疗,争取达到根治手术的目的。
六、直肠癌的分期
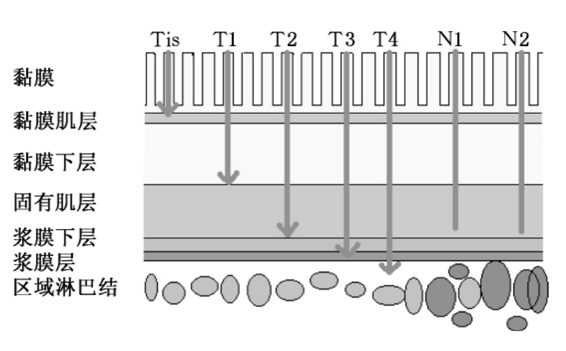
图11-1 直肠癌的TNM分期示意图
目前常用的直肠癌分期是由国际抗癌联盟(International Union Against Cancer,UICC)和美国癌症联合会(the American Joint Committee on Cancer,AJCC)根据原发肿瘤(T)、区域淋巴结(N)和远处转移(M)提出的TNM分期标准,见图11-1,表11-1。截至2005年,已经出版了第6版。该分期适用于临床病理分期,对判断直肠癌预后有重要指导意义。具体内容包括以下几方面。
表11-1 直肠癌的分期
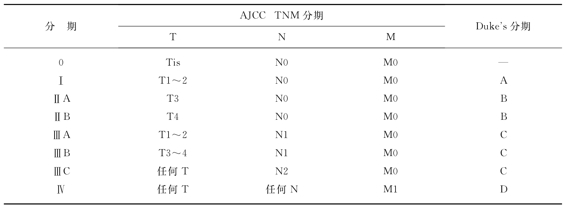
(一)AJCC分期
1.原发肿瘤(T)
Tx 原发肿瘤无法评估。
T0 未发现原发肿瘤存在的证据。
Tis 原位癌(肿瘤位于上皮内或侵犯至黏膜固有层,包括局限于腺体基膜或固有层,没有侵透黏膜肌层到达黏膜下层的癌)。
T1 肿瘤侵犯黏膜下层。
T2 肿瘤侵犯肌层。
T3 肿瘤侵透肌层达浆膜下层或穿透无腹膜覆盖的结、直肠周围组织。
T4 肿瘤直接侵犯其他器官或组织或穿透脏层腹膜。
用V、L代表有否血管或淋巴的侵犯。
2.区域淋巴结(N)
Nx 无法评估淋巴结转移。
N0 无局部淋巴结侵犯。
N1 1~3个淋巴结转移。
N2 4个以上淋巴结转移。
3.远处转移(M)
Mx 无法评估远处转移。
M0 无远处转移。
M1 有远处转移。
(二)Duke’s分期
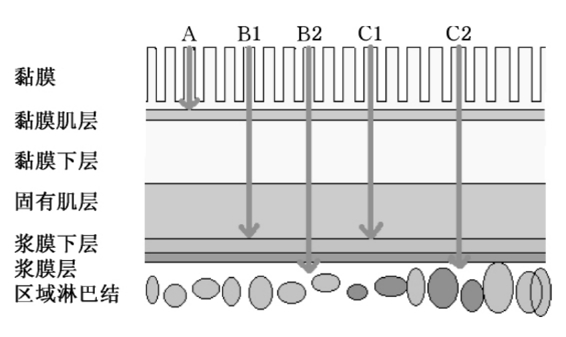
图11-2 直肠癌的Duke’s分期示意图
该分期是1932年由英国著名直肠癌专家Duke’s创立。主要将直肠癌分为A、B、C 3期。经过很多学者的不断改进,Duke’s分期内容更趋于合理、简单、实用,因此至今还在世界范围内广泛使用。目前使用的是1954年由Astler和Coller提出的改良Duke’s分期(MAC分期)。该分期的主要内容是:A期,肿瘤仅限于黏膜层及黏膜下层;B期,B1期:肿瘤侵及固有肌层;B2期:肿瘤侵透固有肌层;C期,C1期:肿瘤局限于肠壁内,但伴有淋巴结转移;C2期:肿瘤已侵透肠壁伴有淋巴结转移;D期,出现远处转移。图11-2为Duke’s分期示意图。Duke’s分期与TNM分期都是目前临床常用分期方法,两者的异同点可见表11-1。
(三)我国直肠癌分期
1990年全国肿瘤防治办公室与中国抗癌协会合编的“中国常见恶性肿瘤诊治规范”中,介绍我国直肠癌临床病理分期方法,主要内容是:Ⅰ期(Duke’s A期):肿瘤未侵透肌层,且无淋巴结转移。可分为3个亚期:Ⅰ0期(A0期):病变限于黏膜层;Ⅰ1期(A1期):肿瘤侵至黏膜下层;Ⅰ2期(A2期):肿瘤侵至肠壁肌层。Ⅱ期(Duke’s B期):肿瘤侵及浆膜或肠外邻近组织,但无淋巴结转移。Ⅲ期(Duke’s C期):已出现淋巴结转移。进一步可分为两个亚期,C1期:出现肠旁及系膜淋巴结转移;C2期:肠系膜动脉切断结扎处出现淋巴结转移。Ⅳ期(Dukes D期):肿瘤广泛浸润、出现远处转移或种植播散无法切除或不能完全切除。
七、直肠癌的病理
主要类型包括:原位癌、腺癌、髓样癌、黏液腺癌(<50%的黏液癌)、印戒细胞癌(>50%的印戒细胞癌)、鳞状细胞癌、腺鳞癌、小细胞癌、未分化癌等,详见第六章“腹部肿瘤的病理”。
八、预后因素
病理分期仍然是直肠癌最重要的预后因素。1932年,Duke’s提出了对直肠癌的Duke’s分期标准,虽几经修改,但肿瘤浸润肠壁的深度和区域淋巴结受累仍然是该分期中最重要的核心原则。美国癌症联合会(AJCC)根据原发肿瘤(T)、区域淋巴结(N)和远处转移(M)提出了TNM分期标准。该标准已经成为最常用的结、直肠癌分期标准,并成为判断结、直肠癌预后的重要指标(表11-2)。(https://www.xing528.com)
表11-2 直肠癌生存率与肿瘤的分期关系

另外,科学、合理和有效的治疗措施也是判断直肠癌患者预后的重要因素。多项前瞻性研究报道,伴有远处转移的直肠癌患者经过化疗后可明显延长生存时间,提高生活质量。对13项临床试验进行的Meta分析结果显示,伴有远处转移的直肠癌患者,全身化疗可以将1年生存率从34%提高至50%,中位生存期可延长3.7个月。
除病理分期和相关治疗以外,文献报道中的预后独立因素还包括肿瘤残留、组织学类型、分化程度、血清癌胚抗原和细胞因子水平、静脉外膜侵犯、起源于腺瘤的腺癌侵犯黏膜下血管、患者KPS评分等。小细胞癌、印戒细胞癌和未分化癌较其他组织学类型预后差。侵及黏膜下的肿瘤发生淋巴转移的危险性增高。
随着分子生物学的发展,肿瘤表达的一些特殊细胞因子如DCC(deleted in colorectal cancer)基因、APC(adenomatous polyposis coli,结肠腺瘤性息肉病蛋白)、p53、p27、DNA MSI(microsatellite instability,微卫星不稳定性)等也可能与预后有关,但这些细胞因子与直肠癌预后的确定关系仍需要进一步探讨。
九、直肠癌的治疗
(一)外科手术
只有外科手术切除直肠癌是唯一的根治手段,目的是切除肿瘤及清扫周围区域淋巴结。近20年来,直肠癌的外科治疗也取得了较大进展,并有了新的根治概念和原则。治疗模式已经从“生物学模式”向“生物-社会-心理模式”转变,在保证生存率不降低的前提下,更注重良好的生存质量。直肠癌根治术后的5年生存率达到50%~70%,早期直肠癌5年生存率超过90%,但直肠癌单纯手术治疗后复发率仍较高,早期T1~2N0M0的病例术后复发率<10%,而T3N0M0的病例术后复发率可达15%~35%,T3~4N1~2M0的病例术后复发率可高达45%~65%。另外,术后远处转移也是直肠癌手术切除失败的主要原因。
成功的直肠癌根治手术必须符合以下条件:①肿瘤边缘距切缘要足够长;②清扫足够的淋巴组织,及其周围的血管、脂肪,必要时甚至邻近器官;③减少及避免手术中医源性肿瘤细胞的种植及转移;④在根治原则下,尽可能的保留肛门功能。
术前外科医生应该运用多种检查手段进行准确的术前评估,以判断:①是否需要新辅助放、化疗;②决定术式及切除范围;③可否保留肛门。手术前一般需要进行X线胸部片、腹部脏器(特别是肝脏)B超、盆腔CT或MRI检查,明确直肠邻近组织、肺、肝、腹腔淋巴结是否有癌浸润或转移。最近发展出的确定直肠癌侵犯肠壁程度,可采用直肠超声内镜(endorectal ultrasonography,EUS)、盆腔CT或MRI检查手段,结果比较可信。这些检查可以最大限度地确定肿瘤分期,选择合适的治疗方案。常见直肠癌根治手术术式有下列几种。
1.经腹会阴联合切除术 经典的直肠癌根治术为1908年Miles提出的“经腹会阴联合切除术”(Miles式)。该术式的理论基础认为,直肠癌的扩散(特别是淋巴结)是朝着各个方向的、整个环绕直肠的组织,尤其是肛提肌、坐骨肛管窝脂肪和肛周皮肤,皆为“高度危险组织”,即“圆柱”概念。切除这些组织结构可以在很大范围内减少肿瘤细胞残留,从而降低术后的局部复发率,以提高术后生存率。该术式成为直肠癌根治术划时代的进步,成为20世纪80年代直肠癌经典术式,适合于所有可以手术切除的直肠癌,因而得到了广泛的推广。但该术式切除范围广、损伤大,不能保留肛门,患者不能控制排便以及出现性功能减退等问题,成为外科治疗中的遗憾。目前,Miles式术已经成为可手术直肠癌的最后一种选择。
2.低位前切除术 Dixon在1948年提出了“低位前切除吻合术”(Dixon式)。该术式适用于直肠肿瘤下缘在腹膜反折水平以上、与肛缘距离>10cm的患者。于腹腔切除肿瘤后,在腹膜外吻合,保留肛提肌、肛门及内外括约肌,解剖结构保存较好,患者自主控制排便效果佳,生活质量明显改善。目前,上段与中段直肠癌大多可以行低位前切除术+结肠肛管吻合术,在根治原则的前提下保留肛门及括约肌,提高患者生活质量。随着外科手术水平的进步以及吻合器、缝合器等手术辅助器械的出现,肿瘤与肛缘距离对低位前切除术的限制越来越小。目前认为,肿瘤下缘与肛缘距离>5cm的患者都可行保肛手术。虽然该术式在改善患者生活质量方面有了明显的改进,但术后局部复发仍然是导致治疗失败的重要原因。
3.全直肠系膜切除术 1982年,Heald提出了“直肠系膜”概念,认为被盆筋膜脏层包绕的直肠周围结缔组织即为直肠系膜,其中含有丰富的脂肪、神经、淋巴和血管,直肠及其系膜因固有筋膜的包裹而成为一个解剖单位。在该理论基础的指导下,Heald提出了“全直肠系膜切除术”(TME)。TME其实并不是一个崭新的术式,而是在Dixon术式基础上对手术操作步骤、技巧提出的改进。TME的基本概念为直视下完整地锐性切除直肠、肿瘤及至少5cm的直肠系膜,保证切缘阴性。该术式的适应证包括:①直肠中下段癌;②TNM分期T1~3期;③肿瘤未侵出浆膜层;④大多数适合低位前切除的患者。TME术中对直肠系膜的充分游离,使外科医生可以更加容易、充分地保留肿瘤下缘断端5cm的安全距离,并且随着对直肠癌病理学和生物学特性认识的不断发展,外科医生已经相信直肠肿瘤下缘距肛门距离2cm已经足够安全,对于较小的低位直肠癌,1cm的远端边缘距离也可以接受。目前,世界范围内的多项研究已经证明TME术式可以明显降低术后复发率。Heald本人报道的100例直肠癌行TME手术,2年内无1例复发。Kapiteijin对1 748例TME术后的直肠癌患者进行随访后发现,TME结合术前放疗者,2年局部复发率为2.4%,单纯TME治疗者有8.2%出现局部复发。目前,TME已经成为中低位直肠癌的标准术式,但与正常人相比,尽管TME保留了肛门括约肌功能,手术对盆壁神经的损伤,以及结、直肠顺应性降低、括约肌的收缩功能和反射性抑制降低,使患者排尿功能、术后性生活以及自主控制排便仍未达到理想水平。
1982年,日本学者土屋提出了旨在保存直肠癌患者术后排尿功能和性功能的盆腔自主神经干保留根治术(PANP)。该术式是指根据肿瘤病变部位、局部浸润深度以及淋巴结转移情况,决定是否保留骶前神经丛和双侧盆神经丛,从而保存相应的生理功能。Havenga报道,77例男性直肠癌PANP术后患者中有78%对性生活满意,34例女性患者中有91%保持健全的性功能,但5年生存率和局部复发率与传统根治术无明显差异。虽然PANP可以明确提高直肠癌术后患者的生活质量,但是仍有学者对PANP的根治性治疗效果提出质疑。Moriye报道PANP与非PANP直肠癌术后,5年生存率分别为53%和27%,具有明显的统计学差异,认为这与为避免损伤神经而保留过多神经周围组织有关。虽然对PANP的手术效果仍存有争议,但从目前世界直肠癌外科治疗发展水平来看,仍认为TME+PANP是最合理的术式。
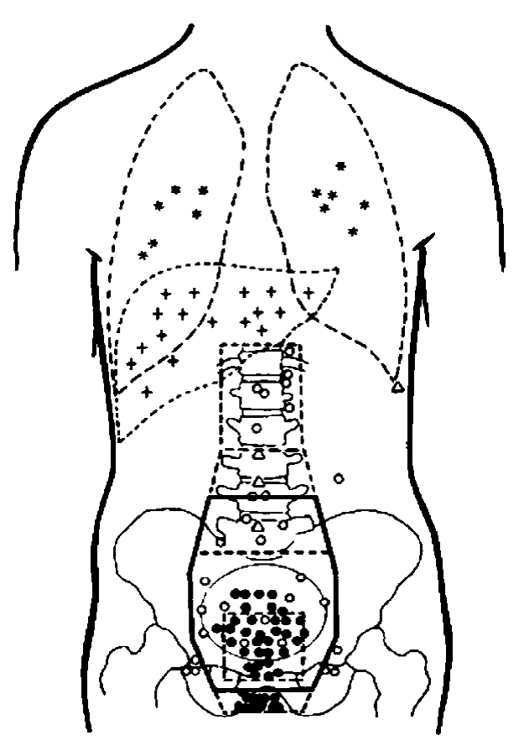
11-3 直肠癌术后转移复发的部位
4.局部切除术 有研究报道,直肠黏膜内无淋巴引流,黏膜下癌淋巴结转移率仅为7%。随着直肠超声内镜(EUS)技术的发展,超声内镜对诊断直肠肿瘤浸润肠壁深度以及肠外淋巴结转移的准确率都已达到较高水平,分别为95%和80%。在此基础上,对早期直肠癌进行局部切除术也成为直肠癌治疗的一种选择模式。对直肠癌患者进行超声内镜评估,可以有助于临床医生发现早期直肠癌患者,并进行合理适当的治疗。对于肿瘤分期T1~2、肠外淋巴结阴性的患者,可行经肛门肿瘤局部切除术。切缘阴性或无不良特征(无淋巴血管浸润或神经周围侵犯;肿块<3cm;中分化以上)的T1和T2病变,其局部切除术后结果与低位前切除术相似,局部复发率为25%。经肛门切除术是距肛门距离<8cm、肠壁受累<30%肿瘤的首选手术。如果局部切除术后病理显示肿瘤组织学分级为3~4级、切缘阳性或淋巴血管浸润,则应该进行开腹手术。对于仅有黏膜下浸润的早期直肠癌患者,局部切除术后可行补救性放疗。Chakravarti报道了99例早期直肠癌患者的局部切除术结果,认为T1分化差,以及所有T2患者均应行局部切除术联合术后放疗,经该方案治疗后5年局控率和5年生存率分别达到90%和74%。
5.外科手术的不足 局部复发是直肠癌手术治疗失败最常见的原因。虽然手术术式和技巧有了长足的进步,但局部复发率仍然徘徊在15%~45%。随着TME手术成为直肠癌外科治疗的金标准,局部复发率明显下降,但在影响直肠癌患者生存期的各项因素中,局部复发仍然是最重要的影响因素。因为手术过程中,会不可避免地出现不同程度的、肉眼难发觉的残留癌细胞,甚至是医源性的肿瘤细胞种植,结果导致瘤床复发以及局部淋巴结转移。直肠癌单纯手术治疗后的局部复发率非常令人担忧(表11-3)。Gunderson等研究也认为直肠癌手术治疗失败的主要原因是局部复发(图11-3)。复旦大学附属中山医院收集133例直肠癌术后影像学诊断为区域局部复发转移,其发生率见表11-4所示,主要集中在真骨盆内,而骨盆外转移的比率很少。我们根据这133例直肠癌术后复发的部位,建议修订直肠癌术后放疗野的范围。为降低术后复发,目前世界有多项关于术前放疗的临床试验研究,已经证实术前放疗和(或)联合化疗可以提高局部控制率,降低术后复发率,但是否延长生存率仍需进一步观察。从总的趋势来看,直肠癌术前的综合治疗对患者的预后是非常有利的。
表11-3 直肠癌术后盆腔转移复发与Duke’s分期的关系
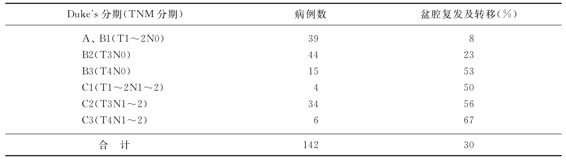
表11-4 133例直肠癌患者术后出现腹盆部区域转移复发比率

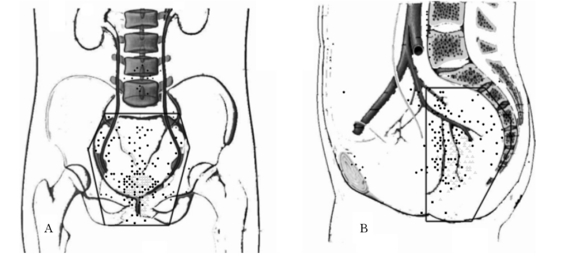
图11-4 133例直肠癌术后局部复发转移的部位
△为吻合口复发;●为盆腔内淋巴结转移;■为会阴部复发;★为腹壁、造瘘口或皮下种植或复发;◆盆外淋巴结转移
(二)化疗
单纯依靠外科手术不能降低局部复发率和远处转移率。术后放疗也只能降低局部复发率,没有足够的证据说明可延长生存时间,失败的主要原因还是远处转移。直肠癌单纯手术治疗后复发率仍较高,早期T1~2N0M0的病例术后复发率<10%,而T3N0M0的病例术后复发率可达15%~35%,T3~4N1~2M0的病例术后复发率可高达45%~65%,并且外科手术不能控制术后的广泛转移从而导致治疗失败。另外,大部分直肠癌患者诊断时已经发展成为局部进展期,甚至已经出现远处转移。因此,综合外科、放疗、化疗是直肠癌治疗的模式。化疗是直肠癌综合治疗中的一个重要手段。对于复发、转移性直肠癌,化疗可以延长患者的生存期、改善生活质量。
化疗可以分为术前化疗(新辅助化疗)和术后化疗(辅助化疗)。术前化疗的适应证为分化程度低、侵及广泛、计划行保肛手术的患者。术后化疗的适应证为组织学残留,包括肉眼残留、切缘阳性和盆腔冲洗液检测到肿瘤细胞;肿瘤侵犯浆膜;直肠周围脂肪组织受累;血管或淋巴管受累;区域淋巴结转移。
1.氟尿嘧啶 氟尿嘧啶仍然是直肠癌化疗中重要的药物。主要通过抑制胸苷酸合成酶抑制细胞内嘧啶核苷酸的合成,从而抑制细胞生长。氟尿嘧啶通常与甲酰四氢叶酸(LV)联合使用。后者可以增加氟尿嘧啶与胸苷酸合成酶结合物的稳定性,从而增强了对DNA合成的抑制。对于进展期直肠癌,联合氟尿嘧啶与甲酰四氢叶酸治疗可以使20%患者的肿瘤缩小50%,与未经治疗的患者相比较可以使生存期从6个月延长至11个月。氟尿嘧啶的主要不良反应是造血系统毒性和胃肠道反应。这些反应与氟尿嘧啶的给药方式有关:如采用一次性给药模式,最常见的不良反应是中性粒细胞减少症以及口腔炎;如采用每周少量分次给药模式,则常见的不良反应是腹泻等胃肠道症状。使用氟尿嘧啶持续静脉灌注给药模式,可以明显降低造血系统毒性和胃肠道症状,但会增加手足综合征的发生率。尽管如此,采用持续静脉灌注给药的方式可以获得更为有效的治疗效果。
口服氟尿嘧啶的前体药物卡培他滨(商品名:希罗达)是一种需经过酶代谢3个过程,最后主要在肿瘤内转化为氟尿嘧啶。其不良反应与静脉使用氟尿嘧啶相似。但是,手足综合征更为突出,其他不良反应则包括腹泻、恶心、呕吐和骨髓抑制。已经有两项临床试验比较了卡培他滨和Mayo Clinic化疗方案的治疗效果,结果发现两种治疗方案的总生存期相似(12~13个月),但卡培他滨的客观有效率有中等程度的提高。静脉使用氟尿嘧啶的患者,其口腔溃疡和骨髓抑制的发生率高,而口服卡培他滨的患者出现手足综合征较为突出。
与静脉使用氟尿嘧啶方案相比较,口服氟尿嘧啶单药治疗更具安全、方便,但治疗效果并无明显优于静脉给药。在晚期大肠癌联合化疗方案中,对卡培他滨与5-Fu/LV治疗效果方面仍存在争议。曾有两项随机临床试验,对比研究了口服卡培他滨和氟尿嘧啶静脉给药的治疗效果,获得了相似的结果。
2.氟尿嘧啶辅助化疗 以往认为,对已经完全切除的Ⅱ期或Ⅲ期直肠癌患者,使用氟尿嘧啶作为辅助化疗是没有效果的。这是由于以往进行的临床试验因病例数较少或者化疗方案不理想而受到了限制。20世纪90年代,精心设计的Ⅲ期直肠癌随机临床试验证明氟尿嘧啶静脉给药或联合氟尿嘧啶与甲酰四氢叶酸可以改善治疗结果。Gill对7项关于Ⅱ、Ⅲ期结肠癌使用氟尿嘧啶辅助化疗的临床试验进行荟萃分析,结果发现5年生存率从51%提高至64%,并且对老年或青年患者都有效。
3.氟尿嘧啶的局部治疗 目前针对肝转移病灶常采用介入治疗并动脉内灌注氟尿嘧啶或其类似药物——氟尿苷进行局部治疗。虽有研究认为介入治疗可以提高转移病灶的控制率,但并没有生存优势。有随机研究比较了肝转移灶单纯行外科手术、手术+动脉灌注与全身化疗3种治疗方式的治疗效果,结果发现并无治愈方面的提高,但动脉灌注组与全身化疗组的2年生存期具有统计学差异。
4.伊立替康 伊立替康(CPT-11,开普拓)是一种天然喜树碱的半合成衍生物。该药物通过与拓扑异构酶Ⅰ相结合,干扰细胞DNA的复制和转录,使DNA单链发生断裂,引起细胞死亡。主要不良反应有腹泻、骨髓抑制、恶心、呕吐和脱发。
两项随机临床研究的结果显示,伊立替康作为进展期结、直肠癌经氟尿嘧啶治疗后失败的二线药物,与最佳支持治疗和氟尿嘧啶持续静脉灌注治疗相比较,可以使总体中位生存期延长2~3个月。Saltz与Douillard分别进行了伊立替康联合氟尿嘧啶和甲酰四氢叶酸静脉推注方案(IFL)与48h持续静滴5-Fu/LV方案,作为一线治疗转移性结、直肠癌的临床研究,结果显示三药联合治疗较5-Fu/LV疗效提高2倍,肿瘤缩小50%以上,生存期延长2个月。
但联合应用伊立替康与5-Fu/LV可以明显加重骨髓抑制和腹泻等不良反应,并增加治疗相关死亡率。因此,联合三药治疗应注意患者耐受性与安全性。
5.奥沙利铂 奥沙利铂为第三代铂类衍生药物,通过与细胞DNA分子形成络合物而引起细胞凋亡。奥沙利铂在进展期结、直肠癌的治疗效果已经得到肯定,尤其与5-Fu/LV联合应用(FOLFOX方案),能够增加有效率,延长患者的无病生存,提高患者的行为评分,改善患者生活质量,但在生存期方面无统计学优势。Gramont比较了FOLFOX 4与单用5-Fu/LV的疗效,两种方案有效率分别为50%和22%,中位无进展生存期分别为9个月和6.2个月,FOLFOX 4方案疗效较好,但总生存期无明显优势(16.2个月和14.7个月)。FOLFOX的化疗方案已经成为目前直肠癌化疗的标准方案。
奥沙利铂的不良反应与顺铂和卡铂不同,肾毒性、耳毒性、脱发等较少见,常见的为神经毒性。大多数患者治疗期间如暴露于低温等诱因,可出现手足、口唇周围神经感觉迟钝、麻痹等周围神经症状,随着治疗停止,这些症状会逐渐消失。
6.靶向治疗 目前,两种生物靶向治疗药物西妥昔(cetuximab)和贝伐他汀(bevacizumab)已逐渐进入临床治疗。
(1)西妥昔 表皮生长因子受体是一种跨膜糖蛋白,调控细胞生长、分化、增殖和凋亡的信号传导通路。该受体分布于正常上皮细胞表面,并在肿瘤细胞呈过度表达。有研究已经证实,这种过度表达与结、直肠癌的较差预后存在相关性。西妥昔(cetuximab或Erbitux或C225单抗)是一种抗表皮生长因子受体胞外结合区的单克隆抗体,已经为美国FDA批准,用于转移性结、直肠癌的治疗。临床前期研究已经证实,西妥昔单抗与化疗药物之间存在协同作用,并且对伊立替康耐药的肿瘤细胞仍然有效。Saltz等对121例伊立替康治疗无效的进展期结、直肠癌患者采用西妥昔单抗联合伊立替康的治疗,结果发现19%的患者影像学显示肿瘤缩小。同时为了确定是两种药物的协同作用还是西妥昔单抗产生的抗肿瘤效果,对60例相似患者给予西妥昔单药治疗,结果其中10%的患者出现了明显的肿瘤缩小。Cunningham也证实了Saltz的研究结果,将329例对伊立替康耐药的进展期结、直肠癌患者进行随机分成两组,分别接受西妥昔单抗+伊立替康联合治疗和西妥昔单抗单药治疗。结果发现,联合治疗组患者肿瘤缓解率达23%,生存期为8.6个月,而单药治疗组分别为11%和6.9个月。这些研究结果均证实了西妥昔单抗对部分结、直肠癌患者治疗的有效性。该药物的不良反应较轻,主要为皮肤痤疮样皮疹和干裂等症状,偶有注射过程中的过敏反应发生。
(2)贝伐他汀单抗 肿瘤生长依赖血管的形成,并且在生长过程中,肿瘤也不断诱导血管的形成。这一机制也促使人们尝试通过抑制肿瘤的血管形成途径而控制肿瘤的生长和转移。贝伐他汀单抗(bevacizumab,avastin)是一种直接作用于血管内皮细胞生长因子的人源化抗体,已经与化疗药物联合应用于多项进展期结、直肠癌临床试验中。在一项小型的Ⅱ期随机临床试验中,伴有远处转移的结、直肠癌患者分别接受贝伐他汀和5-Fu/LV治疗,结果贝伐他汀组获得了较好的肿瘤缓解率。该研究结果也促成了目前正在进行的两项Ⅲ期临床试验。Hurwitz等将815例患者随机分成IFL+贝伐他汀组和IFL+安慰剂组进行治疗。使用贝伐他汀组患者有效率明显提高,总体中位生存期延长4.7个月,达到20.3个月(对照组为15.6个月)。Kabbinavar的研究则发现贝伐他汀+5-Fu/LV可以明显提高肿瘤缓解率和延长肿瘤进展时间,但不能延长中位生存期。最近,ECOG进行的一项Ⅲ期临床试验却发现贝伐他汀+FOLFOX4可以延长中位生存期达12.5个月(对照FOLFOX4组为10.7个月)。在Hurwitz和Kabbinavar进行的临床试验中,贝伐他汀的主要不良反应是可逆性的高血压和蛋白尿,但患者基本上可以耐受。美国FDA已经批准了将贝伐他汀联合含有氟尿嘧啶的治疗方案,作为进展期结、直肠癌的初始治疗。目前的临床研究证实了含有贝伐他汀的联合治疗有效,但认为单用贝伐他汀治疗却无明显效果,并且与非静脉给药的氟尿嘧啶方案联合应用的有效性尚不清楚。
(三)放疗
1.放疗指证 TNM分期Ⅱ~Ⅲ期或Duke’s分期B、C期的直肠癌患者,尤其是对于肿瘤位置较低、并拟行腹会阴联合切除的直肠癌患者,更推荐行术前放疗,TNM分期Ⅰ期以及伴有远处转移的直肠癌患者不应使用术前放疗。直肠癌术后放疗仍然是辅助治疗中的主要模式,术后放疗的适应证:①肿瘤≥T3,即肿瘤侵入深肌层或侵透肠壁,或Dukes分期≥B2期;②TNM分期≥Ⅱ期;③原发肿瘤残留;④区域淋巴结转移。对不能手术切除的直肠癌患者,包括原发灶局部晚期、术后盆腔淋巴结复发转移、吻合口复发,可以结合化疗药物和姑息放疗,以缓解症状。对出现远处转移的患者,应首先考虑全身化疗,如果远处转移灶控制良好,可以姑息放疗盆腔病灶,目的是缓解症状(如疼痛、出血)。
2.放疗依据 局部复发是直肠癌治疗失败最常见的原因。不同分期术后局部失败的发生率:T1~2N0M0<10%;T3N0M0/T1N1M0 15~35%;T3~4N1~2M0 45%~65%。目前已经完成的多项前瞻性随机对照临床试验已经证明,无论直肠癌行术前放疗还是术后放疗都可以降低局部复发率,并有利于延长生存期。对于局部晚期直肠癌患者,行姑息性放疗可以起到止痛、止血等效果,目的是改善晚期肿瘤患者的生活质量。因此,直肠癌的放疗是肿瘤综合治疗中一个重要部分,应当引起广大医疗工作者的重视。
3.放疗技术 术前放疗多采用盆腔前后两野垂直对穿照射或两个侧野一个后野的三野等中心照射,也曾有报道采用四野等中心盒式照射。照射野包括原发肿瘤、肠周及盆腔淋巴引流区。模拟定位前应提前口服造影剂,并可酌情行钡剂灌肠,为定位提供参考。患者可采用俯卧位,可使用腹板以减少小肠的照射容积,保持定位与放疗时膀胱充盈状态相一致。如果受条件限制,患者也可以采用仰卧位。传统的直肠癌放射野定位是在模拟机下确定,上界:第5腰椎椎体下缘。下界:根据肿瘤远端边缘距肛缘的距离决定,如果肿瘤为高位,可顺利施行Dixon保肛根治术,下界可设定在闭孔下缘,如果肿瘤为低位,施行保肛手术有一定困难时,应该将下界设定至肛门水平。侧界:如采用前后两野对穿照射,两侧界应达真骨盆外缘1~2cm;如采用三野等中心照射,两侧照射野应包括耻骨联合后缘及骶尾骨的1/2。术前放疗剂量及分割方法目前并无统一标准,Glimelius等进行的Meta分析认为生物有效剂量(BED,biological effect dose)>30Gy可以明显降低术后局部复发率。因此,我们认为术前给予20Gy/5次、30Gy/10次,或常规分割剂量1.8Gy/次,累积剂量45~50.4Gy等方法皆可采用,4~6周后进行手术。目前国内外尚未进行临床试验来探讨术前放疗不同模式的具体差异。
术后放疗多采用三野或四野等中心照射。照射野包括吻合口、术后瘤床、盆腔淋巴引流区。定位前准备与术前放疗相似,并保持定位与治疗时胃肠道与膀胱处于相似状态。推荐采用俯卧位+腹板,并真空袋或体模固定。前后野:上界为第5腰椎椎体下缘,有学者建议应根据术后病理淋巴结转移范围确定上界,如淋巴结转移较广,可将上界确定至第3腰椎椎体水平,但该照射方法可明显增加肠道并发症;下界根据肿瘤部位确定,如行Dixon保肛手术,则下界在闭孔下缘水平,如行Mile术,下界则应为会阴切口外缘水平;两侧界为真骨盆外1~2cm。两侧野:前界为耻骨联合后缘,后界必须包括骶尾骨的一半。三野(一后野两侧野)照射,其剂量比例常为3∶1∶1或2∶1∶1,四野(前后及左右野)盒式照射剂量比例常为1∶1∶0.5∶0.5。放疗剂量全盆腔40~45Gy后,局部可追加10~15Gy,如后程采用三维适形可使局部剂量达64Gy。
4.术前放疗 又称新辅助放疗。术前放疗的优点:①术前直肠及肠周组织解剖结构未被破坏,血供良好,肿瘤细胞相对氧合状况较好,对射线敏感性较术后为高,有利于放射线杀灭原发灶肿瘤细胞及可能出现的肠周亚临床灶或淋巴结内的转移癌细胞,降低肿瘤局部复发率及区域淋巴结转移率。术前放疗常与化疗相结合,良好的血运可以提高肿瘤组织中化疗药物的浓度,对放疗起到一定程度的增敏作用或协同作用。②术前盆腔解剖结构未发生破坏,不会造成进入盆腔内小肠体积的增加,并且小肠蠕动等生理功能处于正常水平,行盆腔野放疗对小肠的损伤较小。③术前放疗具有“降期”作用,一部分不能行手术治疗的局部晚期直肠癌患者经术前放疗,肿瘤缩小,区域淋巴结消失,手术难度变小;部分可以手术但不能保留肛门的直肠癌患者,可以经术前放、化疗达到保留肛门的目的,进而提高术后生活质量。④进行术前放疗,或者联合放、化疗,可以观察治疗效果,对术后的综合治疗具有一定的指导作用。
但术前放疗也有不足之处。对于早期直肠癌如T1~2N0的患者行术前放疗,将导致过度治疗,因为早期直肠癌仅通过局部切除术就可获得良好的预后;对于已有远处转移的患者行术前放疗,则错失了进行综合治疗的时机,最后导致疾病进展迅速。随着目前各种先进辅助检查的出现,以上两种情况是可以避免的。直肠腔内超声对诊断直肠肿瘤浸润肠壁深度以及肠外淋巴结转移的准确率已分别达到95%和80%,借助CT、MRI以及PET可以对患者进行系统检查,发现远处转移病灶,对患者状况进行正确评估,进而指导临床治疗。
5.术后放疗 术后放疗是直肠癌术后辅助治疗的重要手段,主要是预防肿瘤的局部复发。术后放疗常与化疗结合,可以弥补相互之间的不足。目前认为,只要直肠癌患者存在盆腔淋巴结转移的可能,均需术后放疗。因此,有人主张只要病理报告有黏膜下浸润,就有必要进行术后放疗。但临床上我们常针对肿瘤浸润直肠全层或有直肠周围淋巴转移者,才主张术后放疗。
术后放疗的优点是可以准确了解直肠癌患者的病理分期,特别是肿瘤的分子生物学特征,为术后治疗提供依据。术后放疗的缺点是直肠空缺部位由小肠填充,这部位又是术后放射野,以及受肠蠕动限制,放射性肠炎发生率及严重程度较高。
6.姑息性放疗 T4的患者肿瘤浸润邻近组织,手术切除难度大,这些患者接受剖腹探查的结果,有一部分患者的肿瘤得到大部分切除,但存有肉眼可见的残存灶;另一部分患者未能手术切除,外科医生会为这部分患者行Hartman手术,即直肠改道造瘘术,因为这部分患者迟早会出现梗阻症状。有的患者存在内科疾病,难以承受手术切除。除此之外,有相当一部分患者接受“根治术”后出现吻合口复发或盆腔淋巴结转移复发,失去手术切除的机会。不管是不能切除或部分切除,还是伴有内科疾病,或是转移复发的患者,均可以接受内科姑息治疗,也可以单纯放疗,以及可以结合化疗。
7.放疗效果
(1)术前放疗的效果 术前放疗可以降低局部复发率。Pahlman等学者进行了一项多中心随机对照研究,提出直肠癌术前放疗比术后放疗更加有效。之后,在全世界范围内进行了多项大规模临床试验以明确术前放疗的有效性。DCCG(dutch colorectal cancer group)对1 805例直肠癌患者进行随机分组研究,一组是术前放疗组,给予5Gy/次连续5次的放疗后结合TME手术;另一组是仅接受TME手术,2年局部复发率分别是2.4%、8.2%(P<0.001),术前放疗组明显好于单纯TME手术组。Swedish Rectal Cancer Trial对1 168例可手术切除的直肠癌患者进行随机对照分组研究,术前放疗组给予低分割5Gy/次×5次,放疗后1周内行手术,5年局部复发率为12%,而单纯手术组为27%,具有统计学意义(P<0.001)。中国医学科学院肿瘤医院进行的随机临床研究,术前放疗组和单纯手术组的局部复发率比较为14%∶47%(P<0.001)。另外,EORTC以及RTOG等多项临床试验也获得了一致的结果。
术前放疗不增加急、慢性毒性反应。Minsky等学者进行的临床研究发现,术前放疗可以降低急性毒副反应(术前放疗13%,术后放疗48%,P<0.05)。德国直肠癌研究组(German rectal cancer study group)将823例T3/4或区域淋巴结阳性的直肠癌患者,随机分为术前放、化疗组和术后放、化疗组,结果发现术前放、化疗组局部复发率为6%,而术后放、化疗组为13%(P=0.006)。而3/4级急性不良反应如腹泻、造血系统毒性、皮肤反应等发生率仅为27%,低于术后放、化疗组的40%(P=0.001)。慢性毒性反应如慢性腹泻、肠梗阻、吻合口瘘等发生率也远低于术后放、化疗组(14%∶24%,P=0.001)。术后死亡率和并发症两组间结果相似。但对于术前放疗引起的毒性反应仍存在一定争议,DCCG的研究认为术前放疗可增加术中出血量和腹部并发症的发生。StockholmⅠ试验与Imperail Cancer Research Fund试验的研究则认为术前放疗可导致术后死亡率增高。因此,对于术前放疗的急、慢性毒性反应仍需进一步探讨。
术前放疗具有“降期”作用。对22项随机试验的8 507例直肠癌患者进行的系统回顾性分析认为,局部进展期直肠癌行术前放疗可以提高手术切除率和保肛率。但进行低分割快速放疗和放疗后短期内进行手术则不能达到降期的目的。Francois等研究术前放疗与手术时间间隔与降期作用的关系,结果发现放疗后6~8周组与放疗后2周组,比较两组肿瘤缩小率为71.7%∶53.1%(P=0.007),前者病理分期下降26%,后者为10.3%(P=0.005)。我们认为,常规分割放疗总剂量45~50Gy,分割剂量1.8Gy/次,放疗4~6周后进行手术是合理的。一方面可以使正常组织得以恢复,另一方面肿瘤细胞凋亡、肿瘤体积缩小需要一定的时间,以达到降期目的。
(2)术前放疗与保肛手术相结合 直肠癌术前放疗可以改善患者的生存情况,并能使中下段直肠癌患者免于行直肠造瘘术,保留括约肌功能,保持肛门的排便功能。NSABP进行一项临床研究,对首诊的患者,由医生判断能否手术切除,对可以接受手术切除的患者,随机分为术前放疗与术后放疗两组,术前放疗的患者,50%保留了括约肌功能,而术后放疗的患者仅33%保留住括约肌功能。关于术前放疗可以提高保肛效果的临床结果,最有影响的因素来自德国的报告,其术前与术后放、化疗均采用180cGy/次和5-Fu持续灌注120h,结果是术前放疗患者对保留括约肌有明显优势,未行术前放、化疗即予行腹会阴手术者,只有19%保留括约肌功能,而术前放疗者达到39%,且术前放疗组局部复发率只有7%,术后放疗为11%,两组差别有显著意义(P=0.02);中位随访43个月的结果显示,术前放疗组无病生存期稍高于术后放疗组(59%∶55%,P=0.23)。术前放疗组患者出现吻合口狭窄为2.7%,术后放疗组为8.5%,两组差别有显著意义(P=0.001)。
(3)术后放疗效果 1990年,NIH就已经提出对Ⅱ期和Ⅲ期直肠癌行术后辅助放、化疗。2001年,结、直肠癌协作组(colorectal cancer collaborative group,CCCG)对业已完成的22项关于直肠癌放疗的随机对照临床试验进行了Meta分析,结果发现,与单纯手术治疗直肠癌相比较,术后放疗可以降低37%的局部复发率,但没有一项试验结果可以证实,术后单纯放疗可以延长生存期。2003年,Glimelius B等学者对世界上已经进行的42项随机对照临床试验结果和3项Meta分析结果进行荟萃分析,结果认为术后放疗可以使局部复发率降低30%~40%,但没有证据表明术后放疗可以提高生存率,而术后放疗与化疗结合却可以明显改善生存状况。因此,医学界对直肠癌术后辅助放疗可以降低局部复发率获得了一致认同,但对改善生存状况则认为不能依赖单一的放疗模式。
(4)姑息性放疗 皇家马德里医院报道67例原发灶不能手术切除的直肠癌患者,接受外放疗后,其5年生存率为2%,局部失败率为91%。Overgaard报道,无远处转移的患者接受4 600cGy的姑息放疗,2年生存率为30%。Sloan-Kettering纪念医院报道3年生存率为30%。
Mayo Clinic报道106例术后局部复发的直肠癌患者,接受姑息性切除(次全切除),48%的患者术后用5-Fu化疗,34例接受术中放疗或残存灶姑息放疗,3年生存率为44%,局部病灶导致死亡为40%,远处转移引起死亡者占60%。单因素分析表面镜下残存较肉眼残存的姑息切除预后好,肿瘤的数目、位置、是否固定和结合放疗也影响患者的预后,提示对局部复发者应采用积极治疗。
上海罗氏公司曾组织北京大学、复旦大学两所大学的附属医院共同研究直肠癌盆腔淋巴结转移复发的治疗。自2002年6月至2003年10月,100例直肠癌术后盆腔淋巴结转移患者,接受复发灶60Gy的外放疗,放疗期间口服希罗达825mg(m2·d),分2次口服。随访到73例。结果显示完全、部分缓解率分别为45%(33/73)、12%(9/73),有效率为58%。肿瘤进展时间为13个月,中位生存时间为16个月。Ⅰ、Ⅱ级不良反应为白细胞降低32%,手足综合征26%、腹泻22%;Ⅲ级不良反应为手足综合征3%、腹泻3%。其结论是直肠癌术后盆腔淋巴结转移复发,用希罗达结合外放疗是安全有效的。
8.放疗并发症 直肠癌放疗过程中常见的并发症有:①恶心、呕吐、食欲下降等胃肠道症状。②放射性肠炎,可以发生在放疗期间,早者发生在开始放疗后的2周,表现为大便次数增多、稀便和里急后重;放疗结束后若干个月,仍存在腹泻症状,这种慢性放射性肠炎还可以出现肠出血、穿孔、坏死和梗阻。③放射性膀胱炎,常发生在放疗过程中,很少发生在放疗后的几个月里,因为膀胱对射线的耐受性较高。④骨髓抑制,放、化疗同步者较容易出现末梢血白细胞减低。⑤放射性皮肤损伤,常发生在肛门周围的皮肤,严重者出现皮肤溃破,影响放疗进行。
这些并发症可通过一定措施降低其发生率。如:①全盆腔照射后,局部加量尽可能采用三维适形技术,如条件许可则采用调强治疗。②全盆腔照射量达到预防剂量后应及时缩野,局部补量。③放疗科医生与肠道外科、化疗科医生共同讨论,缩小预防性放射野的范围、合理应用化疗药物,选择合适分割剂量。④尽可能采用高能射线进行多野照射。⑤射野内重要脏器、骨骼应进行挡铅保护,患者放疗时保持膀胱充盈,以便小肠被推出放射野。⑥放疗过程中饮食应以易消化、低纤维素为主,放疗期间不进食奶类食品,因为腹泻时对乳糖的消化能力下降。⑦保持外阴清洁,避免泌尿系统感染的发生。
直肠癌放疗后复发进行两次放疗常可产生较严重并发症。早期可出现皮肤及黏膜损伤、放射性肠炎及膀胱炎、骨髓抑制等;晚期可出现软组织坏死、盆腔神经损伤、骨折、输尿管阻塞和小肠梗阻、坏死。因此,两次放疗应采取积极措施将并发症的发生降低至最低限度。如避免两次放疗射野入射方向与第一次放疗方向重叠,尽可能全程使用三维适形多野照射或调强治疗,照射野面积以包括复发病灶靶区即可。放疗剂量为30~45Gy。
十、展望
直肠癌术后放疗能否提高患者的生存期,这一问题仍存有争议,但术前放、化疗可以提高患者的生存期和减少局部复发率,肿瘤学家基本一致提倡直肠癌的术前放、化疗这一治疗模式。但新的化疗药物不断出现,目前RTOG正在进行局部晚期(T3/4)直肠癌,结合不同化疗药物的放、化疗作为新辅助治疗的Ⅱ期临床试验(课题编号RTOG 0247),这一项研究结果将确定新辅助放、化疗中的合适化疗药物和剂量。术后放疗出现放射性肠炎的发生率高,我们现在引用的放射野是20世纪80年代制订的范围,当时尚不流行全系膜切除(TME),如今大多数医院采用TME术式,复发率有显著下降,复发范围有所改变,术式的改变是否带来放射野范围的改变?目前还无这方面的资料支持缩小放射野以减轻放射性肠炎的临床证据,我们正通过随访TME术后复发的类型和位置,并通过缩小放射野来观察复发率是否增加,可望重新规定TME术后放射野范围。由于分子生物学的进步,我们也在研究术后局部复发与肿瘤基因表达的关系,以决定何种基因表达的直肠癌需要术后放疗或化疗。分子靶向药物如Cetuxi和Avastin单抗在直肠癌中起着明显的疗效,这些药物如何与放疗结合,需要Ⅱ、Ⅲ期临床试验。
(孙 乔 曾昭冲)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




