
图6-1 生物质下吸式气化炉
生物质气化过程,从宏观上看可以分为受热干燥、受热裂解、氧化反应、还原反应等四个阶段。为更好地描述生物质气化过程,下面利用生物质下吸式气化炉讲述生物质气化原理,如图6-1所示。生物质从干燥层加入下吸式气化炉,依靠自身重力作用,下落至炉底,依次经过干燥、裂解、氧化和还原,气化剂从氧化层加入,灰分和燃气从炉底排出。
在生物质气化过程中,固体燃料经历了一系列不同的反应步骤,包括加热干燥、裂解、气固反应和气相反应,如图6-2所示。与燃烧不同,气化反应由于氧气有限,只产生有限的二氧化碳和水。根据反应器的设计和燃料颗粒的大小,进入气化反应器的单个生物质燃料颗粒的气化反应时间从小于1秒到几十分钟不等。

图6-2 生物质气化过程
6.1.2.1 受热干燥
受热干燥是气化的第一步,在100~200℃温度下生物质从含水量10%~50%降至完全干燥状态。但去除生物质原料中多余的水分,将会增加合成气中水蒸气、CO2和N2(空气气化剂)的含量,从而降低合成气的有效热值,阻碍合成气下游的应用,同时降低气化系统整体效率。
生物质中的水分在气化过程中会起到重要作用。在气化温度下,水分蒸发形成的蒸汽起气化剂的作用,与挥发分和炭反应,将其转化为合成气,并参与水煤气转换反应,可提高合成气中氢气含量。但是,生物质中过多的水分会降低气化系统热效率。这是因为过多的水分会造成显著的汽化潜热损失,影响系统整体热效率。因此,生物质中适当的水分含量对气化是有利的,为获得更高的热效率,通常要求生物质原料含水量低于25%。
生物质原料进入气化炉后进行最终干燥,吸收气化炉氧化区放出的热量。这种热量使原料预热并蒸发其中的水分。在100℃以上,生物质中的结合水被不可逆地去除。随着温度的进一步升高,生物质低分子量组分开始受热分解,析出挥发分,进入下一步受热裂解阶段。
6.1.2.2 受热裂解
生物质在无氧条件下的快速分解称为热裂解。当物料温度升高至200℃时,干燥后的生物质开始发生裂解;温度达到300~400℃时,生物质发生剧烈的裂解反应,大量析出挥发分,挥发分主要成分为水蒸气、H2、CO、CO2、CH4、焦油以及其他碳氢化合物。受热裂解完成后,会产生多孔固体——焦炭,其主要组成为碳和无机化合物(灰分)。
在气化温度下焦炭不会进一步挥发,但可以继续与气化环境中的反应性气氛发生反应。生物质焦炭通常比煤焦更具多孔性和反应性,其孔隙率为40%~50%,而煤焦的孔隙率仅为2%~18%。生物质焦炭的孔隙(20~30μm)比煤焦的孔隙(约0.5 nm)大得多,因此它的反应行为不同于煤衍生的炭。
6.1.2.3 氧化反应
氧化反应指的是裂解产生的焦炭以及挥发分中可燃气体与气化介质中的氧气发生剧烈氧化反应,放出大量的热,并将其提供给干燥、裂解以及还原反应,维持气化反应所需能量。氧化反应区域最高温度可达1000~1200℃。此区域主要化学反应式为

6.1.2.4 还原反应
经过氧化反应后,还原区已没有氧气存在,裂解产生的挥发分以及氧化区域产生的燃烧产物在此区域与剩余焦炭发生还原反应,生成CO和H2,完成固体生物质向气体燃料的最终转化过程。气体之间同时会发生水煤气变换反应(WGS)以及甲烷化反应,其决定了气化合成气的最终气体组成。因为还原区域大部分反应为吸热反应,此区域温度会相应降低到700~900℃,吸热热量来源于氧化区域燃烧热。此区域主要化学反应式如下:

其中,焦炭气化反应(式(6-5)、式(6-6)两个气固反应)是最重要的反应,由于焦炭气化反应比裂解反应以及氧化反应要慢得多,占据了整个气化进程的大部分时间,因此焦炭气化反应是决定气化速度的反应。
总的来说,生物质气化涉及一系列复杂的化学反应过程,在实际气化过程中,上述四个阶段没有明确的边界划分。生物质气化主要反应发生在氧化区域和还原区域,所以称氧化区域和还原区域为气化区。表6-1列出了气化过程中一些常见的反应。
表6-1 气化过程中一些常见的反应

注:表中给出的各种反应热是在25℃温度条件下的值。
6.1.2.5 气化反应动力学
气化炉中的所有反应并非都是瞬时且完全按照平衡计算将反应物转化为生成物的。上述化学反应都是以有限的速率和有限的程度进行的,因此它们可能不会在气化反应器内全部完成。一方面,反应进行到什么程度取决于反应后的平衡状态。另一方面,其动力学速率决定了在给定的流体动力学条件下,反应产物形成的速度以及反应是否在气化炉室内完成。在讨论化学平衡的结果之前,先介绍化学平衡的基本概念。
1.化学平衡
生物质气化反应同大多化学反应一样,在原始物料进行正反应的同时,反应生成物之间根据化学反应条件的不同会发生不同程度的逆反应。
假设下式是一个可逆反应:
![]()
式中:n、m、p和q是化学计量系数;脚标for表示正向。反应速率r1取决于反应物A和B的浓度CA和CB:
![]()
同样,化学反应也可以朝逆方向移动:
![]()
式中:脚标back表示逆向。
逆反应的速率r2同样取决于反应物C和D的浓度CC和CD:
![]()
当反应开始时,反应物A和B的浓度较高,产物C和D的浓度较低。因此正反应速率r1最初远大于逆反应速率r2,因为r1>r2,这种反应状态为非平衡状态。随着反应进行,正向反应增加了产物C和D,从而增大了逆反应速率。最后,当两个反应速率相等(r1=r2)时,就会达到平衡状态。平衡时:正反应速率等于逆反应速率,反应物和产物的浓度没有进一步变化,系统的吉布斯自由能最小,系统的熵最大。
在平衡状态下:
![]()
反应速率常数kfor与kback与反应物浓度无关,取决于反应温度T。反应速率常数的温度依赖关系用阿伦尼乌斯(Arrhenius)公示表示为
![]()
式中:A是指前因子,R是通用气体常数,E是反应活化能。
正、逆反应速率常数之比为平衡常数Ke:
![]()
表6-2给出了不同温度下一些常见气化反应的平衡常数和生成焓的值。
表6-2 不同温度下一些常见气化反应的平衡常数和生成焓

2.吉布斯自由能
吉布斯自由能G是一个重要的热力学函数,反映在给定温度T下,熵的变化ΔS和焓的变化ΔH,吉布斯自由能可以写成
![]()
根据系统中各气体的焓或熵的变化,能够计算出反应系统的焓或熵的变化。一种常见的计算方法是使用Probstein和Hicks给出的经验方程。它以在1 atm和298 K的参考状态下的形成热以及温度来表示吉布斯函数(式(6-19))和生成焓(式(6-20))。

式中:Δ 是气体在1 atm、298 K下的生成焓;T是气体温度;a'、b'、c'、d'、e'、f'、g'等是经验系数,其值可从相应的工具书中查询得到。
是气体在1 atm、298 K下的生成焓;T是气体温度;a'、b'、c'、d'、e'、f'、g'等是经验系数,其值可从相应的工具书中查询得到。
通过吉布斯自由能值可以得出在温度T下发生反应的平衡常数,即
![]()
式中:ΔG是反应的标准吉布斯函数或反应的自由能变化;R是通用气体常数;T是气体温度。
3.气固反应动力学
生物质焦炭气化速率比其生成过程的裂解速率慢得多,所以气化炉体积更多地取决于焦炭气化速率,而非裂解速率。因此,焦炭气化反应在气化炉设计和运行中起主要影响作用。
固定式和流化床气化炉中气化区的常见温度范围为700~900℃。焦炭气化区中发生的三种最常见的气固反应如式(6-5)、式(6-6)、式(6-7)所示,碳-水反应(式(6-6))在水蒸气气化炉中占主导地位。当空气或氧气为气化介质时,主要发生Boudouard反应(式(6-5))。水蒸气气化反应速率高于Boudouard反应速率。另一个重要的气化反应是在气相中发生的WGS反应(式(6-8)),将在下一节对其进行讨论。
气固碳-水反应速率可以用n阶表达式表示:
![]()
式中:X为碳转化率分数;A0为表观指前因子(s-1);E为表观活化能(kJ/mol);m为碳转化率反应级数;T为温度(K) 为气体分压,n是相对于气体分压的反应级数;R为气体常数,取8.314 J/(mol·K)。
为气体分压,n是相对于气体分压的反应级数;R为气体常数,取8.314 J/(mol·K)。
1)Boudouard反应
对于Boudouard反应,可以使用考虑CO抑制的Langmuir-Hinshelwood(朗格缪尔-欣谢尔伍德)速率来表示表观气化反应速率rb:

式中:PCO和PCO2分别是焦炭表面上CO和CO2的分压;kb1、kb2、kb3为反应速率常数,根据式(6-16)计算。
当CO浓度相对较小,且不考虑其抑制作用时,Boudouard反应的气化动力学速率可用一个简单的n阶方程表示:
![]()
对于Boudouard反应,生物质焦活化能值通常在200~250 kJ/mol范围内,而指数n的值在0.4~0.6范围内。桦木、杨树、棉木、黄杉木、麦秸和云杉木焦炭的指前因子A、活化能E和反应级数n的典型值见表6-3。(https://www.xing528.com)
表6-3 Boudouard反应中典型生物质的反应参数

Boudouard反应的逆向反应对催化反应影响较大,因为此逆向反应会在催化剂表面产生积碳,从而导致催化剂失活。
![]()
当![]() 大于Boudouard反应的平衡常数时,上述反应在热力学上是可实现的。
大于Boudouard反应的平衡常数时,上述反应在热力学上是可实现的。
2)碳-水反应
考虑到氢和其他反应物的抑制作用,碳-水反应的动力学速率rw也可以用Langmuir-Hinshelwood的形式描述:
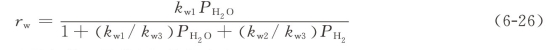
式中:Pi(i为H2O和H2)是气体i的分压,单位为bar。
但是,大多数动力学分析可使用一个更简单的n阶表达式来表示反应速率:
![]()
表6-4列出了典型生物质碳-水反应的指前因子A、活化能E和反应级数n。
表6-4 碳-水反应中典型生物质的反应参数

3)碳氢反应
碳氢反应将碳与氢结合形成甲烷(式(6-7))。此反应在初始阶段,初生无定形焦炭与氢反应速率较高,随着高温下碳的石墨化,反应速率迅速降低,因此高升温速率有利于此反应的进行。此外,此反应涉及反应体系体积增加,因此高反应压力也有利于此反应的进行。Wang和Kinoshita测量了此反应的速率,得到指前因子A=4.189×10-3s-1,反应活化能E=19.21 kJ/mol。
4)烷烃蒸汽重整反应
若要生产合成气(CO、H2),可以选择直接重整烷烃,一般在700~900℃温度下使用镍基催化剂,使烷烃(碳氢化合物)和蒸汽发生反应,产生合成气。合成气随后可以合成所需的液体燃料或化学原料。产物气的最终成分取决于以下因素:重整温度、反应压力、入炉料的氢碳比、蒸汽与碳之比。
烷烃蒸汽重整反应可以描述为

4.气相反应动力学
几种气相反应在气化过程中起着重要作用。其中,将一氧化碳转化为氢气的WGS反应(式(6-8))最为重要。该反应是温和的放热反应。由于反应体系总体积没有变化,因此它对压力因素相对不敏感。WGS反应的平衡常数随温度升高而降低。为了获得较高的氢气产率,反应不能在很高的温度下进行,但较低的反应温度又限制了反应速率。因此,要达到最佳的反应速率,需要使用催化剂。在400℃以下,可以使用铁铬催化剂(Fe2O3-Cr2O3)催化WGS反应。
其他气相反应包括CO和H2的氧化反应(表6-1中R6和R8反应),均为放热反应,为其他吸热的气化反应提供热量。表6-5给出了以上反应的正向反应速率。
表6-5 气相均相反应的正向反应速率和生成焓

对于CO氧化的逆反应![]() ,反应速率kback可以写作:
,反应速率kback可以写作:

对于WGS反应的逆反应![]() ,反应速率kback可以写作:
,反应速率kback可以写作:
![]()
如果已知正向反应速率常数,则可以利用吉布斯自由能方程中的平衡常数来确定逆向反应速率常数kback。在1个标准大气压下,平衡常数Ke为
![]()
WGS反应的ΔG0可以由以下简单的相关公式计算:
![]()
式中:温度T的单位为K,ΔG0的单位为kJ/mol。
5.焦炭反应性
焦炭反应性是指焦炭与二氧化碳、氧气和水蒸气等反应气体进行化学反应的能力,反应性大小可由给定气化剂、温度、压力等反应条件下的反应速率体现。因为焦炭气化是整个气化反应中决定反应速率的步骤,因此所有气化炉模型中焦炭反应性是最重要的参数之一。
焦炭反应性主要由三个因素决定:①焦样自身物理化学结构;②无机矿物质含量;③颗粒的孔隙率。焦样自身物理化学结构比如焦炭微晶结构存在缺陷可以形成更多的活性位点。无机矿物质可以在焦炭进一步氧化反应(气化或燃烧)中充当催化剂。焦炭颗粒的孔隙率决定其比表面积,进而控制反应气体以及反应产物气体在焦炭颗粒中的扩散速率。而裂解条件通过影响上述三个因素进而影响着焦样的物理化学性质及其反应性。
1)裂解温度影响
裂解终温对裂解产物的分布以及焦炭结构和反应性起到了决定性作用。焦炭气化反应性随着裂解温度的提高而下降,这是由于随着裂解终温的升高,半焦的碳微晶结构变得更加规整,将出现较多的芳香环结构,从而减少了半焦的反应活性位点。
2)停留时间影响
停留时间指的是样品在达到裂解终温时在反应器内停留的时间。停留时间对煤裂解的影响受温度的制约,其主要影响二次裂解反应,促进裂解产物进一步裂解。停留时间的延长会导致生物质半焦的炭微晶结构变得更加规整,进而使生物质半焦的气化反应速率降低。此外,裂解过程中在峰值温度停留时间的延长也会降低反应活性。
3)升温速率影响
升温速率会影响燃料裂解阶段的脱挥发分过程,其主要通过影响燃料裂解过程中挥发分和焦的二次反应来改变裂解产物的分布以及焦结构。升温速率对燃料焦结构和反应性的影响已有广泛的研究。在较低升温速率下,裂解产物从颗粒自然孔道中释放,因此半焦表面形态和孔结构没有太大变化,导致焦孔隙结构并不发达;而在高升温速率下,更多未交联缩聚形成惰性半焦的大分子碎片在高温下迅速挥发,形成“造孔”效应,使半焦的孔隙结构发生明显变化,大量微孔和中孔结构形成,从而增加了焦样的比表面积,最终提高了焦炭颗粒的反应性。也有学者认为相比高升温速率条件,低升温速率下所得半焦表面沉积的碳更多且缺陷结构减少,从而使得半焦的气化反应性降低。
4)矿物质影响
煤、生物质等碳基燃料中存在一定量的矿物质,灰分来源于它们气化或燃烧后的产物。矿物质主要为K、Na、Mg、Ca、Fe、Al等金属元素,其赋存形态主要有以下三种:①离子态与羧基官能团结合的形式;②水溶性盐类形式;③无机金属氧化物形式。这些不同形态的金属元素在燃料裂解和进一步的焦气化过程中均产生一定的催化作用,可以有效降低反应活化能,提高反应活性。需要注意的是,半焦中的矿物质只能在一定温度范围内促进半焦的反应性,由于催化剂化学结构或半焦结构的改变,矿物成分在一些特定反应条件下会抑制焦气化进程。如高温下K会与硅酸盐作用生成KAlSiO4,CaCO3与高岭石作用生成钙铝黄长石等,这些没有催化作用的复合硅酸盐使得半焦的反应活性减小。
6.1.2.6 燃料特性
燃料特性通常采用工业分析、元素分析、灰分成分分析和发热量来评估。这些分析方法提供了有关燃料水分含量、挥发分、主要组成元素的相对含量、热值以及燃料灰分成分使气化炉结焦倾向的信息。目前,生物质燃料特性分析方法主要参考煤的分析方法。
1.工业分析
工业分析是了解燃料特性的主要方法和基本依据,根据工业分析的各项测定结果可初步判断燃料性质、种类和各种燃料的加工利用效果及其工业用途。工业分析按照水分M、挥发分VM、灰分A和固定碳FC对燃料进行分类。工业分析检测过程主要步骤如下:在惰性反应条件(一般是氮气气氛)下以低升温速率加热燃料至不同温度,测量水分(105℃)和挥发分(950℃)释放份额从而计算其相对含量。需要注意的是,高温裂解化学反应产生的水归为挥发分VM的一部分。随后将以上残留部分燃烧,燃烧后残留部分即灰分份额,损失份额即固定碳对应的份额。固定碳份额一般由以下物料平衡公式获得:
![]()
工业分析指标能有效筛选用于特定种类气化炉的燃料,煤中挥发分含量高有利于煤的气化和碳转化率的提高,但是挥发分含量太高的煤种容易自燃,会给储存带来一定麻烦。表6-6给出了各种生物质和固体燃料的工业分析数据,从表中可以明显看出,生物质挥发分含量一般都高于煤炭的,因此随后产生的固定碳含量明显低于煤炭的,这是由煤炭的高度芳香结构构成导致的。此外,大多数生物质的灰分含量都比煤炭的要低。
表6-6 生物质和固体燃料的工业分析数据

续表

2.元素分析
元素分析就是测定固体燃料中的元素组成,用各元素相应质量占燃料总质量的百分数(即质量分数)来表示,通常包括碳(C)、氢(H)、氧(O)、氮(N)和硫(S),在某些燃料中氯(Cl)含量很高,需额外关注。
碳是煤及生物质燃料中最主要的可燃元素,煤中含量范围一般在15%~80%(干燥基),生物质中碳含量一般为40%~60%(干燥基)。氢是燃料中的另一可燃元素,在煤中的含量一般为1%~4%(干燥基),在生物质中的含量一般为4%~6%(干燥基)。氢主要与碳结合形成碳氢化合物,在加热时能以气态形式(挥发分)释放出来。氧是燃料中的不可燃元素,在煤中的含量一般不超过10%(干燥基),在生物质中的含量要明显高于在煤中的含量。燃料的氧含量过高会影响燃料的发热量。
氮、氯和硫通常是燃料中的微量元素,其中氮和氯元素是不可燃元素,硫元素是可燃元素,氮、氯和硫均是燃料中的有害元素,是燃料转化过程中污染物(氮氧化物、氯化氢和硫氧化物)形成的主要元素来源。一般而言,生物质燃料中硫、氮含量远低于煤炭中的,但其氯含量比煤炭的要高。
研究表明,在气化过程中,燃料中的氮元素主要转化为五种形式(见图6-3),其相对比例受运行条件影响。其中,氨(NH3)和氰化氢(HCN)特别受关注,因为已知它们会在下游合成气过程中引起催化剂中毒和NOx空气污染。同时HCN是剧毒物质,其泄漏或排放会对人类生命和健康造成严重危害。此外,气化过程会将氯和硫元素转化为氯化氢(HCl)和硫化氢(H2S),氯化氢和硫化氢同样会造成下游处理工艺中催化剂中毒和失活。同时,氯化氢和硫化氢还会分别加剧气化炉或燃烧设备金属壁面的低温腐蚀和高温腐蚀。
3.灰分成分分析

图6-3 生物质气化过程中当量比对氮转化的影响
燃料中灰分对气化炉性能影响也较大。燃料灰分是在气化炉内的高温、高压条件下,燃料中所有可燃物质完全燃烧及其矿物质组分发生一系列分解、化合等复杂化学反应后的残余物,主要包含金属、非金属氧化物及盐类。灰分分析一般用氧化物形式表示,主要有SiO2、Al2O3、Fe2O3、CaO、MgO、TiO2、Na2O及K2O等。总体而言,燃料中的灰分不利于气化反应的进行。生物质燃料固定碳含量较低,而碳-氧反应是供给气化炉正常运行所需能量的主要来源。一方面,若灰分含量过高,氧化层中碳表面被灰分覆盖,气化剂与碳表面的接触面积减少,使反应强度降低。同时灰分的大量增加,不可避免地增加了残炭排出量,随残炭排出的碳损失量也必然增加。另一方面,灰分组成决定了生物质燃料灰分的灰熔点,生物质燃料灰熔点同样会影响气化炉气化强度和生产能力。气化氧化层中温度较高,通常超过了生物质燃料灰熔点,生物质灰可能熔融并结渣,结渣会破坏气化剂均匀分布,同时增加排灰难度。当严重结渣不能及时从气化炉中清除时,受氧化层固定位置影响,灰渣在炉排上累积到一定高度,就会侵占还原层,使还原区区间减小,还原反应进行得不够完全从而导致气化炉运行温度上升,进一步恶化结焦结渣。如果在气化炉内壁结渣严重,气化炉将被迫停机,这会缩短气化炉寿命。如果采用较低操作温度,则可能会影响燃气质量和产量。一般来说,木本燃料灰分含量很低,一般在5%以内,气化效率高,燃气质量好,可以不考虑灰熔点的限制;而草本燃料如农业秸秆等的灰分含量则高得多,其高碱金属含量使灰熔点降低,结渣倾向比较严重。而且高灰含量使燃料气化消耗量上升,燃气产率下降。
表6-7给出了一些生物质和煤的元素分析、灰分及发热量数据(干燥基)。因为水分含量包含额外的氢和氧元素,为了避免与样品中氢氧元素混淆,元素分析通常在物料干燥后分析,用干燥基含量表示。
表6-7 生物质和煤的元素分析、灰分及发热量

续表

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




