1932年,美国化学家密立根(R.A.Millikan)和德国化学家洪特(F.Hund)提出了分子轨道理论(molecular orbital theory)。分子轨道理论着眼于分子的整体性,它把分子作为一个整体来考虑,比较全面地反映了分子内部电子的各种运动状态。分子轨道理论认为原子在形成分子时,所有电子对成键都有贡献,分子中的电子不再属于个别原子,而是在分子中运动。这样,对分子中的各种成键形式、成键过程的能量变化及分子的空间结构问题都能给出很好的解释。因此,分子轨道理论在共价键理论中占有非常重要的地位。
1.分子轨道理论的基本要点
①分子中的电子围绕整个分子运动,其运动状态可用分子轨道波函数ψ来描述,每个分子轨道都有相应的能量和形状。ψ2是指分子中电子在各处出现的概率密度,或称为分子的电子云。
②分子轨道由组成分子的各原子轨道组合而成。n个原子轨道可以组成n个分子轨道,其中有n/2个分子轨道的能量低于原来原子轨道的能量,叫成键分子轨道(bonding molecular orbital);n/2个分子轨道的能量高于原来原子轨道的能量,叫反键分子轨道(antibonding molecular orbital)。可用图3-21表示如下。
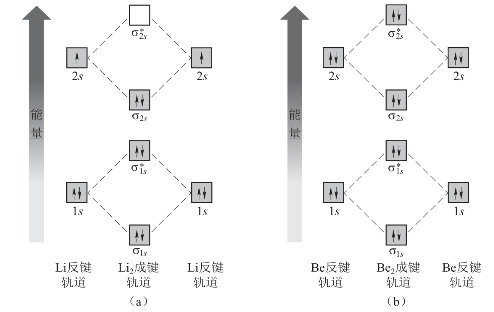
图3-21 Li2和Be2的分子轨道示意图
(a)Li2键级=1;(b)Be2键级=0
如两个Li原子形成Li2分子时,两个Li原子的1s轨道经组合后形成了两个分子轨道;同时,每个Li原子的2s轨道也组合成两个分子轨道,即形成Li2分子时,两个Li原子的4个原子轨道经组合后形成4个分子轨道,其中有两个分子轨道所具有的能量分别低于Li原子的1s轨道和2s轨道的能量,有两个分子轨道所具有的能量分别高于Li原子的1s轨道和2s轨道的能量,而且成键轨道放出的能量等于反键轨道吸收的能量,因此,分子轨道的总能量和原来原子轨道的能量是相等的。
③电子在分子中的排布像电子在原子中的排布一样,也遵守泡利不相容原理、能量最低原理和洪特规则。
2.分子轨道的形成
原子轨道组合成分子轨道需要符合对称性匹配、能量相近和最大重叠三个成键原则,这些原则是有效组成分子轨道的必要条件。
(1)对称性匹配原则
原子轨道有正、负号之分,我们将原子轨道的正值部分与正值部分组合、负值部分与负值部分组合,称为对称性匹配,只有对称性匹配,才能组成成键分子轨道;而正值部分与负值部分组合称为对称性不匹配,只能组成反键分子轨道。
(2)能量相近原则
能量相近原则是要求组成分子轨道的原子轨道能量相近,并且原子轨道的能量越相近,形成分子轨道的能量就越低。如果两个原子轨道的能量相差很大,则具有较高能量原子的轨道中的电子将迁移至能级较低的原子的原子轨道中,从而只能形成离子键。
(3)最大重叠原则
在对称性匹配的条件下,原子轨道的重叠程度越大,成键轨道相对于原来的原子轨道的能量降低值越大,形成的化学键越稳定。
在上述三个原则中,对称性匹配原则是最基本的原则,它决定了原子轨道能否组成成键分子轨道,而能量相近原则和最大重叠原则只是决定了组合的效率,即形成共价键的强度大小。
3.分子轨道的形状与能级图
分子轨道的形状可以通过原子轨道的组合近似地如图3-22所示。

图3-22 原子轨道构成分子轨道
(a)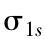 和
和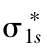 轨道;(b)
轨道;(b) 成键轨道;(c)
成键轨道;(c)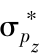 反键轨道;(d)
反键轨道;(d)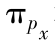 和
和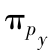 成键轨道;(e)
成键轨道;(e)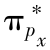 和
和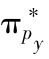 反键轨道
反键轨道
当2个原子的npz原子轨道沿着x轴的方向相互接近,可组合成![]() 成键分子轨道和
成键分子轨道和![]() 反键分子轨道。
反键分子轨道。![]() 轨道与
轨道与![]() 轨道、
轨道、![]() 轨道与
轨道与![]() 轨道,其形状相同,能量相等,只是空间取向互成90°。
轨道,其形状相同,能量相等,只是空间取向互成90°。
每个分子轨道都有相应的能级,这些轨道的能级顺序目前主要由光谱实验数据来确定。将分子中各分子轨道的能级按顺序排列,可以得到分子轨道能级图。图3-23是第二周期元素形成的同核双原子分子的分子轨道能级顺序图。
由能量相近原则可知,两个相同原子形成双原子分子时,只能是能量相近的1s与1s、2s与2s、2p与2p原子轨道组合形成分子轨道。但2s、2p轨道形成的分子轨道的能级也受二者能级差的影响。当2s与2p轨道能量相差较大时,同核双原子分子的分子轨道能级如图3-23(a)所示。此时![]() ;但当2s与2p轨道的能量相差较小时,最终的分子轨道能级顺序如图3-23(b)所示,其中
;但当2s与2p轨道的能量相差较小时,最终的分子轨道能级顺序如图3-23(b)所示,其中![]()
![]()
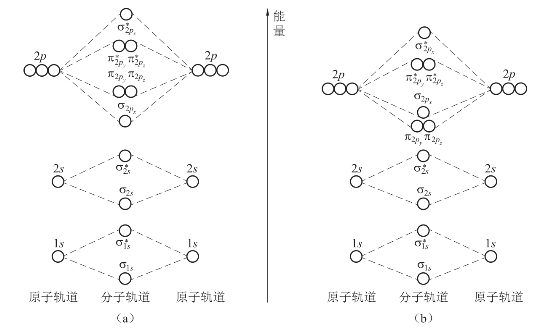
图3-23 同核双原子分子的分子轨道的两种能级顺序
(a)σ2p<π2p;(b)π2p<σ2p(https://www.xing528.com)
在第二周期的各元素中,只有O和F原子的2s、2p原子轨道的能量相差足够大,形成分子轨道时,2s、2p轨道不能有效重叠,因此,形成的O2、F2分子的分子轨道能级顺序如图3-23(a)所示;而N、C、B等原子的2s、2p轨道能量接近,在形成双原子分子时,它们之间也产生重叠,最终形成了如图3-23(b)所示的分子轨道能级顺序。
所以,第二周期元素所组成的同核双原子分子中,从Li2到N2的分子轨道能级排列顺序为:F2、O2分子的分子轨道排列式为:
![]()
![]()
当(σ1s)和![]() 内层分子轨道都充满电子时,常用KK表示
内层分子轨道都充满电子时,常用KK表示![]()
4.分子轨道理论的应用
(1)O2的结构
O2的分子轨道式为:
![]()
在O2分子中,(σ2s)2和![]() 各填满2个电子,由于能量的升高和降低互相抵消,相当于这些电子没有成键。实际上,在O2分子中,对成键有贡献的是
各填满2个电子,由于能量的升高和降低互相抵消,相当于这些电子没有成键。实际上,在O2分子中,对成键有贡献的是![]() 构成O2分子中的1个σ键,
构成O2分子中的1个σ键,![]() 构成O2分子的1个三电子π键,
构成O2分子的1个三电子π键,![]() 构成O2分子的另一个三电子π键。所以O2的结构为:
构成O2分子的另一个三电子π键。所以O2的结构为:
![]()
说明分子中存在2个自旋方向相同的成单电子(具有顺磁性),这与实验事实恰好相符。O2分子所具有的结构是价键理论无法解释的,但是用分子轨道理论处理就会很自然地得出结论。
三电子π键中有1个电子在反键轨道上,这就削弱了键的强度,三电子π键不如双电子π键牢固,所以,1个三电子π键相当于半个π键,2个三电子π键相当于1个正常π键。从这个角度来看,分子中仍相当于![]() 双键,但由于存在三电子π键,有未成对的电子和未充满的轨道,所以表现出较大的活性。
双键,但由于存在三电子π键,有未成对的电子和未充满的轨道,所以表现出较大的活性。
(2)N2的结构
N2的分子轨道式为:
![]()
在N2中,(σ2s)2和![]() 对成键没有贡献,只有
对成键没有贡献,只有![]() 对成键有贡献,共形成3个键:1个σ键和2个π键,而且分子中的π轨道的能量较低,使系统的能量大大下降,所以N2具有特殊的稳定性。
对成键有贡献,共形成3个键:1个σ键和2个π键,而且分子中的π轨道的能量较低,使系统的能量大大下降,所以N2具有特殊的稳定性。
5.键级和分子的稳定性
分子所具有的稳定性,在分子轨道理论中常用键级(bond order)的大小来衡量,键级表示两个相邻原子之间成键的强度。
键级=1/2(成键轨道电子数-反键轨道电子数)
一般来说,键级越大,键长越短,所形成的键越牢固,分子就越稳定,如果键级为零,表示两个原子不能成键形成分子。如:
N2的键级=1/2×(8-2)=3,O2的键级=1/2×(8-4)=2
因N2的键级比O2的键级大,所以N2比O2稳定。
键级的大小与键能的大小有关,一般来说,键级越大,键能越大。如表3-10所示。
表3-10 键能与键级的关系
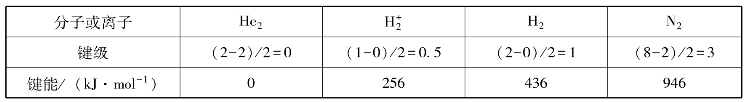
键级只能定性地推断键能的区别,粗略地估计分子结构稳定性的大小,事实上,键级相同的分子,其稳定性也可能有差别。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




