结合前述分析可知,“宏观辨识与微观探析”素养的培育,就是要在化学教学过程中,培养学生从更为本质的微观视角看待物质及其变化的基本思路。具体来说,要求教学过程中:
1.帮助学生将宏观现象还原为微粒间的作用与运动,揭示宏观现象背后的本质属性,理解化学符号蕴含的物质及其变化的本质含义。
2.帮助学生建立物质及其变化所表现出的宏观事实是物质微观结构及微粒相互作用的内在本质反映的基本假设,从而理解化学基本概念和原理,认识化学现象的本质,掌握化学变化的基本规律。
3.促进学生形成结构决定性质、性质决定用途的基本观念,并能综合运用有关知识,从宏观和微观相结合的视角分析与解决一些化学问题,积极参与有关化学问题的社会决策活动等。

图2-2-2 化学学习与研究的基本路径
如何培养学生建立起微观视角看待物质及其变化的思路、从宏观和微观相结合分析与解决实际问题的视角,从而培育学生“宏观辨识与微观探析”化学学科核心素养?我们知道,基础教育阶段的化学学习与研究,通常按图2-2-2所示流程来展开。即从物质及其变化的基本问题入手,通过观察、实验等手段获取物质及其变化的宏观事实,运用微观模型与假说(即化学理论)分析与解释宏观事实;或从已有化学理论出发,对物质及其变化作出预测与分析,并通过实验等方法对预测进行证实或证伪。最后,用独特的化学符号或术语来表示化学物质及其变化的事实、规律与理论。为此,培育“宏观辨识与微观探析”素养,可采用图2-2-3所示的教学程序来进行。
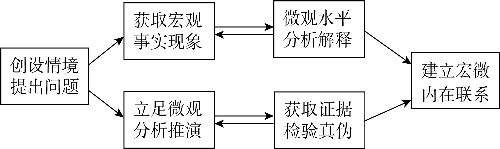
图2-2-3 培育“宏观辨识与微观探析”素养的教学程序
化学教学时,教师根据学习目标要求,创设教学情境,提出问题,以引导学生聚焦学习目标。在此基础上,或通过实物观察、实验探究等相关学习活动,获取物质及其变化的相关事实现象,并从物质结构与反应本质的微观层面进行分析解释,从而建立起宏观事实现象与微观结构、本质的内在联系;或立足于物质结构与反应本质的微观视角进行分析推演,形成物质及其变化的初步认识,进而开展实验探究、查阅资料等学习活动,获取相关事实证据以证实或证伪微观推演形成的初步认识的科学性,最终建立事实现象与微观本质的相互关系。
四、培育“宏观辨识与微观探析”素养的教材分析与教学设计
【案例1】“化学反应中的质量关系”教材分析
质量守恒定律是化学反应微观本质的宏观表现,只有理解化学反应的微观本质,并从微观本质的视角揭示化学反应前后质量关系,才能深刻理解质量守恒的内涵与原因。沪教版九年级化学教材,在引导学生回顾化学反应物质变化及能量变化的基础上,直接提出“化学变化中物质的质量发生变化吗”的问题,并引导学生回顾火柴燃烧、铜片加热等现象,激发学生探究兴趣。同时指出,要回答这一问题需“对物质变化进行定量研究”,从而明确探究的方法手段,引导学生初步感悟定量研究在化学研究中的意义。接着,教材安排了“活动与探究”栏目。此栏目较为全面地揭示科学探究需经历“提出问题—猜想与假设—收集证据—实验探究—结论与反思”等历程,并在“收集证据”环节引入波义耳、拉瓦锡等定量研究化学反应的化学史实,发展学生科学探究的能力,引导学生学习定量研究的科学方法。在实验探究并获得“化学反应前后物质总质量保持不变”这一结论基础上,要求学生开展“交流与讨论”活动。活动安排了两个任务:任务一要求运用质量守恒定律解释“木炭燃烧质量减小”“铁钉生锈质量增大”的现象,不仅巩固质量守恒定律的内容,而且帮助学生准确理解“参加化学反应的各物质的质量总和”“反应后生成的各物质的质量总和”这些条件;任务二则要求学生从物质构成的微粒在化学反应中变化的视角揭示质量守恒定律的微观本质,并以金属镁和氧气反应为例来加以分析,建立起宏观现象(质量相等)和微观本质(微粒重组)的关系,深化对质量守恒定律的理解。
因此,本节教材的编写思路,很好地体现了“宏观辨识与微观探析”核心素养培育的要求。强调基于实验探究等活动来获取宏观事实、探究化学变化规律,进而从微观视角来揭示宏观事实背后的本质及其原因。在本课学习的基础上,还将学习用化学方程式来描述化学变化,实现从“宏观事实”“微观本质”和“符号表征”等维度认识化学变化,并建立起三者间的联系,实现自动转化,从而逐步培养“宏观—微观—符号”三重表征化学学科思维。
【案例2】发展学生微粒观的“电离”单元教学[11]
1.“电离”单元学习要求分析
对于“电离”,高中必修阶段提出“知道酸、碱和盐在溶液中能够发生电离,通过实验认识离子反应及其发生条件,了解常见离子的检验方法”的学习要求。这一要求实际上要解决“什么是电离”“电解质如何电离”“为什么要学习电离”以及“什么是离子反应”“离子反应发生的条件是什么”“学习离子反应有何价值”等问题。其中,后三个方面以前三个方面为基础,是“电离”知识的应用与发展。
上述六个方面问题的学习与解决,很好地帮助学生认识与理解“化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用”的学科特质和“加深对物质世界的认识……更深刻地认识科学、技术和社会之间的相互关系”的课程性质。具体体现为:一是学会从微观视角看待物质及其变化,学会从微观角度认识物质在水溶液中的存在及行为、性质及反应,初步建立起研究水溶液系统的思路和方法;二是认识到化学反应遵循的条件性和规律性,建立看待化学问题的统一视角;三是认识到化学知识在生产生活和科学研究中的应用,学会用欣赏眼光看待化学科学,领悟化学的社会价值。
2.“电离”学习认知发展线索
如何优化“电离”教学设计以达成上述目标?首先要厘清学生对“电离”认识发展的线索。对“电离”认识的发展,学生先要建立起对“电离”本体知识的认识,然后应用“电离”知识解决相关问题,进而建立起微观视角看待物质及其变化的认识思路与方法,感悟物质变化的规律性和统一性,了解化学知识在生产生活中的应用。具体的认识发展过程为:①基于知识回顾和实验观察,通过单一物质在水溶液中存在形态及其行为的分析,建立“电离”概念,掌握“电离”的本体知识;②学习使用化学用语表征单一物质在水溶液中的行为,建立电离方程式的概念,将“电离”概念转化为抽象的符号思维;③通过对一类物质(如酸、碱或盐等)在水溶液中存在形态特点及其性质关系的分析,学习从电离视角看待物质组成与分类,建立起物质微观组成与性质间关系的认识;④基于电解质在水溶液中的存在情况,分析推理强电解质与弱电解质在水溶液中的行为及其存在状态,并通过实验探究,理解物质在水溶液中反应的微观实质和条件,并用离子方程式表征;⑤应用电离与离子反应的知识,开展溶液中常见离子的检验,总结常见离子检验的原则与方法,认识“电离”等知识在生产生活中的应用,感悟从微观视角分析物质及其反应的价值。
3.“电离”单元整体教学规划
环节一 通过设置驱动问题引出电离,认识电解质在水溶液中的行为及结果。
①根据氯化钠固体加入水中逐渐“消失”的现象思考:固体为何“消失”?真的“消失”了吗?
②根据氯化钠溶液能导电的事实思考:溶液能导电说明了什么?为何通电后溶液能够导电?
环节二 学习使用化学符号表征电离,理解电离方程式的意义。
①怎样用化学用语表示氯化钠等电解质在水中的电离过程?
②用电离方程式表示HCl、Ca(OH)2、NaOH、H2SO4和KNO3的电离过程。(https://www.xing528.com)
环节三 从电离的角度认识物质的组成、性质及其相互关系。
①为何HCl、H2SO4等酸的水溶液具有相似的化学性质?
②为何NaOH、Ca(OH)2等碱的水溶液具有相似的化学性质?
③结合“环节二”相关电离方程式的观察,你对酸、碱和盐的组成、性质等有何新的认识?
环节四 建立基于电离视角的物质分类,了解电解质的概念。
氯化钠、蔗糖都是化合物且都能溶于水,所得溶液前者能导电而后者不能导电。请思考:
①两种溶液导电性的差异说明两种物质在水溶液中的存在形式有何差异?
②你能够基于电离的视角对化合物进行分类吗?
环节五 基于电离视角分析电解质在水溶液中反应的本质,学习使用离子方程式表示物质间的反应,理解离子方程式的意义。
①盐酸、氢氧化钠溶液中存在哪些离子?若将两者混合,哪些微粒将相互作用?
②初中“中和反应”的“活动与探究”内容如下:
·在盛有氢氧化钠溶液的烧杯中滴加2—3滴酚酞试液。用胶头滴管吸取盐酸逐滴加入烧杯中,边滴边用玻璃棒搅拌。当烧杯中溶液刚好变成无色时,停止加入盐酸。溶液的碱性发生了什么变化?
·取上述实验所得的少量溶液于一支试管中,另取一根胶头滴管,向试管中加入1滴氢氧化钠溶液,溶液的颜色发生了什么变化?这说明了什么?
·用玻璃棒蘸取实验所得溶液,加热至蒸干,观察到什么现象?这说明了什么?
请结合电离知识,从微粒及其相互作用的视角,分析上述实验现象,回答相应的问题。在此基础上,谈谈对酸碱中和反应、离子反应的认识。
③预测向稀硫酸中逐滴加入Ba(OH)2溶液时,烧杯中溶液离子浓度的变化情况。在预测的基础上,你能设计怎样的实验来证明你的预测?
④对于HCl与NaOH、H2SO4与Ba(OH)2两个反应,如何用化学用语来表示?
⑤对于离子方程式“H++OH═-H2O”,它表示了怎样的反应?
环节六 建立起对复分解反应的本质认识,认识离子反应的条件。
酸与碱、酸与盐(如盐酸与碳酸钠)、碱与盐(如氢氧化钙和碳酸钠)、盐与盐(如氯化钡与硫酸钠)等能够发生复分解反应。
①请从微观(离子间相互作用)的视角分析上述复分解反应的实质。
②结合复分解反应的条件,谈谈对离子反应条件的认识。
环节七 了解常见离子检验方法,感悟离子反应的应用价值,巩固离子方程式的书写。
①现有氯化钠、碳酸钠和硫酸钠三种固体,如何鉴别?写出反应的离子方程式。
②某工厂排放的废液中含有较高浓度的Cu2+、Ba2+和Ag+三种离子。你认为该废液应该进行怎样的处理后才能排放?写出废液处理方案及相关反应的离子方程式。
③结合前述两个问题,谈谈对“离子反应”应用价值的认识。
这样的教学,从关注“电离”概念本体知识转移到从微观视角审视单一电解质在水溶液中的行为与结果,并进一步发展到对多种电解质在水溶液中的行为(相互作用)及其结果的认识。在此基础上,形成从微观视角看待物质在水溶液中行为与结果的认识思路,理解物质变化应具备的条件、遵循的规律,建构与完善“科学物质观”与“微粒观”等化学基本观念,较好地促进学生的认识发展,有效地破解了“‘离子反应’一直是学生学习的难点”的教学难题。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




