如果有一天中国医药工业的新药研发创新能力和技术水平达到和超过了欧美国家,我们面临的问题将迎刃而解。2018年,中金公司的研究报告指出,以上市前研发和新药上市数来衡量,中国目前处于第三梯队,对全球创新的贡献大约为2%,与第一梯队的美国和第二梯队的国家(日韩和西欧)仍有很大差距。据中国医药保健品进出口商会统计,2018年第一季度,中国对美国化药制剂出口额0.9亿美元,其中恒瑞医药、华海药业、南通联亚、人福医药、齐鲁制药等5家位居出口前列,占制剂总出口额的67%。[26]2018年6月,美国《医药经理人》杂志公布2018年全球制药企业排名前50,中国药企无一上榜,值得一提的是,美国、日本仍是全球制药巨头最多的国家,前十强中美国占据6席。中国与“创新药大国”“世界医药强国”还有很大距离。为了追赶,一方面我们需要及时将欧美发达国家批准的优质创新药引进国内,特别是新分子构型的原创药品;另一方面国家必须在制度设计和创新引导上扶持国内的研发型药企做大做强,利用国家的力量与欧美巨型药企进行竞争。最近几年各方面的政策也在马不停蹄的有序出台,积极构建政策支持环境和创新平台。
2015年7月开始进行临床试验数据核查,净化药物研发环境;2015年11月推出上市许可人持有制度(MAH),将研发与制造分离,为创新松绑;2016年2月推出优先审评审批政策,加快临床急需药品的可及性;2016年3月进行化药注册分类改革,以疗效为标准定义创新药;2017年6月加入人用药物注册技术要求国际协调会议(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH;由美国、日本和欧盟三方的政府药品注册部门和制药行业在1990年发起),国内国外新药有望同步上市,打开创新药全球发展空间;2017年版医保目录调整和医保目录价格谈判,医保全力支持创新药放量;2017年10月8日中共中央办公厅和国务院办公厅发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,顶层文件指明医药行业发展最大方向;2018年3月,组建国家医疗保障局,作为国务院直属机构,为药品上市后的医保对接、支付方案做好准备工作;2018年4月国务院办公厅发布《关于改革完善仿制药供应保障及使用政策的意见》,促进仿制药研发;2018年7月,国家药品监督管理局发布《接受药品境外临床试验数据的技术指导原则》。该《指导原则》所涉及的境外临床试验数据,包括但不限于申请人通过药品的境内外同步研发在境外获得的创新药临床试验数据。在境外开展仿制药研发,具备完整可评价的生物等效性数据的,也可用于在中国的药品注册申报,这将改善中国癌症患者此前长时期无望用上最新药物的困境,全球新药有望加速在国内上市。2018年8月8日,国家药品评审中心发布《关于征求境外已上市临床急需新药名单意见的通知》。为加快境外已上市临床急需新药进入我国,国家药品监督管理局、国家卫生与健康委员会组织有关专家,对近年来美国、欧盟或日本批准上市新药进行了梳理,遴选出了Alectinib Hydrochloride等48个境外已上市临床急需新药名单。该名单重点考虑近年来美国、欧盟或日本批准上市但我国尚未上市的用于罕见病治疗的新药,以及用于防治严重危及生命或严重影响生活质量的疾病,且尚无有效治疗手段或具有明显临床优势的新药。纳入境外已上市临床急需新药名单的药品,尚未进行申报的或正在我国开展临床试验的,经申请人研究认为不存在人种差异的,均可提交或补交境外取得的全部研究资料和不存在人种差异的支持性材料,直接提出上市申请,国家药品监督管理局将按照优先审评审批程序,加快审评审批。2018年8月8日,安进宣布Repatha(依洛尤单抗,evolocumab,中文商品名瑞百安)正式获得国家药品监督管理局的批准,用于治疗成人或12岁以上青少年纯合子型家族性高胆固醇血症(HoFH)。Repatha成为首个在中国上市的PCSK9(前蛋白转化酶枯草溶菌素9)型降脂药,是他汀类药物之后最可靠的降脂药。作为首个在中国获批的PCSK9抑制剂,瑞百安为纯合子型家族性高胆固醇血症这一罕见疾病的患者带来生命的希望。2018年8月15日罗氏宣布,国家药品监督管理局正式批准了罗氏安圣莎(阿来替尼)的进口注册申请,用于治疗间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC),为中国ALK阳性非小细胞肺癌患者提供了新的治疗选择。阿来替尼分别于2017年11月和12月才在美国与欧盟获批一线治疗ALK阳性NSCLC,可以说是在中国上市“时滞”最短的一个欧美新药,几乎实现了海外新药在中国与欧盟的同步上市,具有标志性意义,而以往进口抗癌药在国内获批上市,一般要比欧美的上市时间延后5~6年。
在国家政策的帮扶和引导下,在药品研制企业的努力下,最近几年国内创新药物,特别是一类新药取得了较大的进展。
表8-4为最近几年国内一类小分子化学药上市统计。(https://www.xing528.com)
表8-4 2002年至今国内上市的“中国1类”小分子化学药
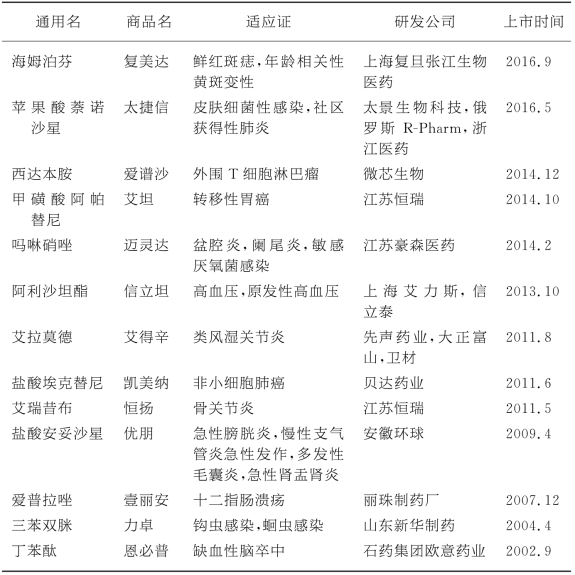
数据来源:药渡数据
2018年6月13日,歌礼生物科技(杭州)有限公司宣布,其开发的抗丙型肝炎1类创新药戈诺卫获得国家药品监督管理局批准上市,2018年6月27日,中国工程院院士、浙江大学附属第一医院教授李兰娟,开出了第一张戈诺卫处方。[27]国家药品监督管理局药品审评中心的数据显示,纳入优先审评审批的29批目录中,有14个丙型肝炎直接抗病毒小分子(direct-acting antiviral agent,DAA)药物品种正申请获批上市,包括11个国产品种。虽然这些所谓的创新一类新药大多数还是跟着全球欧美大药企做跟随创新,大多是me-too、me-better,而不是重磅药,但任何事物都有一个成长过程。当初日本的制药企业不也是从me-too开始一步一步地深入到创新的骨髓中去,最后攀上了创新药品的顶峰的吗?因此我们对国产创新药不应该失望,对普通百姓来讲需要的只是有限的等待时间,应该对国家、政府和药品研发企业抱有信心。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




