硅是地球中含量最高的固态元素,约占地壳质量的25.8%,仅次于氧元素,居第二位。硅在自然界中没有单质状态存在,基本上以氧化态存在于硅酸盐或硅石中。其表现形态为各种各样的岩石,如花岗岩、石英岩、长石、云母、粘土、橄榄石、角闪石等,都是硅酸盐类;水晶、玛瑙、碧石、蛋白石、石英、砂子及燧石等都是硅石。1823年,硅第一次被分离成单质是由瑞典化学家采乌里斯用金属钾和氟化硅还原得到的。1854年,纯净的硅元素结晶是由法国无机化学家德维尔制取的。现在单质硅主要是由石英和碳在高温下还原得到。硅按纯度(硅的质量分数)可分为四个级别:工业硅(95%~99%)、化学级硅(99%~99.9%)、太阳能级硅(99.999%~99.9999%)、电子级硅(99.9999999%以上)。
硅是最重要的半导体材料,其用量占全部半导体材料的90%以上。与锗相比,其禁带宽度大,工作温度高,适用于多种半导体器件生产。除锗外,硅属于周期表中研究最充分的元素。硅具有以下特点:
1)硅资源丰富,无匮乏之滤。
2)硅中杂质的分凝系数对物理提纯非常有利,可以获得接近本征的纯度。
3)SiO2是电学性质极佳的电介质,是MOS电路的重要基础,在工艺上极易操作。
4)硅工艺非常成熟,已形成一个颇具规模的大工业。
5)硅是制造太阳电池的基本原料,地球将从“碳”燃料时代转为“硅”燃料时代。
1.硅的物理性质 硅在常温(300K)下是具有灰色金属光泽的固体,属脆性材料。硅晶体的晶体结构是金刚石型,有九个反映对称面、六条二次旋转轴、四条三次旋转轴和三条四次旋转轴,其全部对称要素为3L44LS6L 9PC。如果加压到1.5GPa,硅晶体就会发生结构变化,由金刚石型结构转变为面心立方结构,此时的晶体常数0.6636nm。
硅的物理性质是决定材料工艺与器件的基础。表5-1列出硅的物理性质。
表5-1硅的物理性质
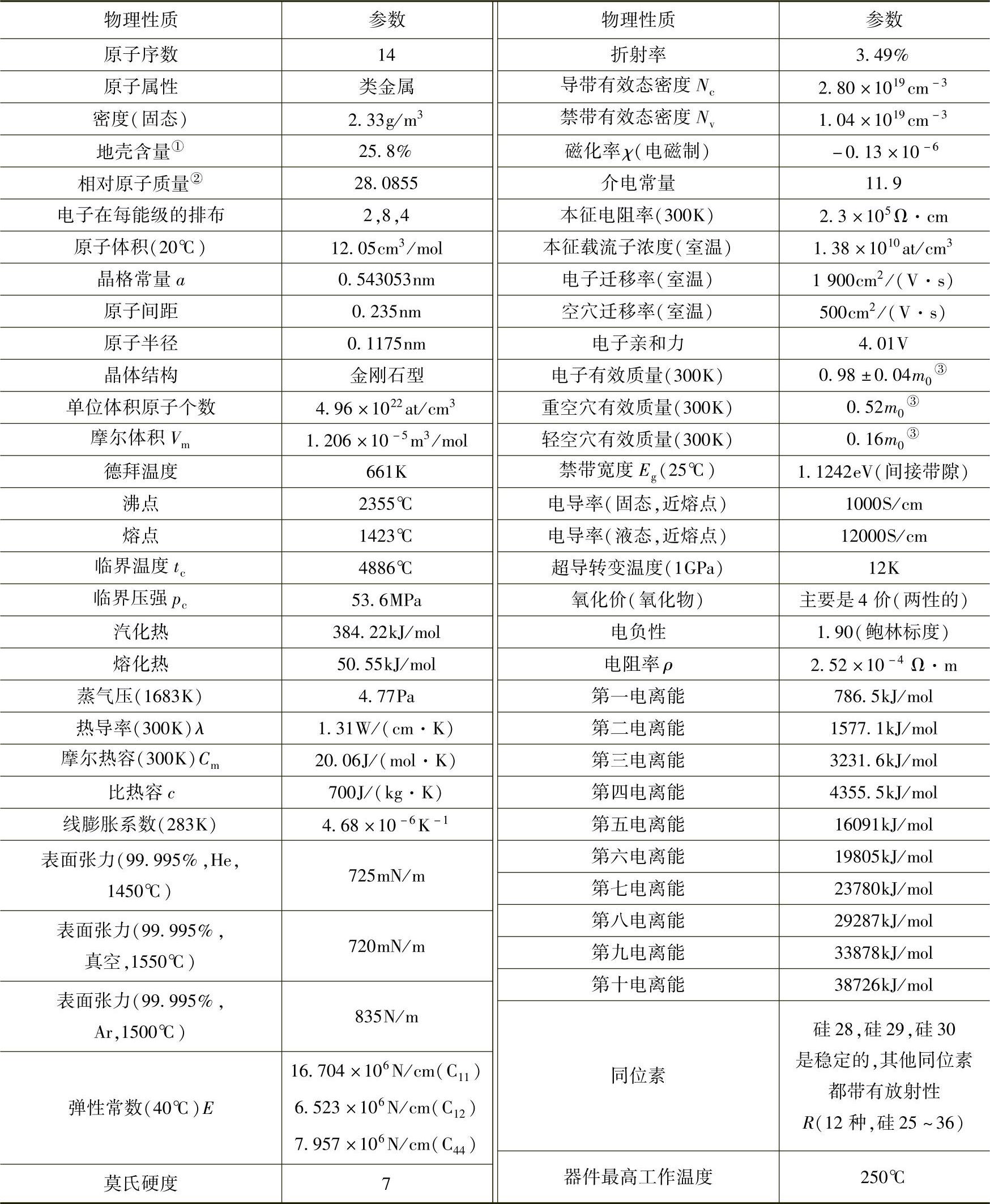
注:硅(Si)是元素周期表的第三周期第四主族。
①“地壳含量”是指一种元素在地球表面中的含量,通常使用百分比表示。地壳中含量最高的是氧,其次是硅、铝、铁、钙、钠、镁。
②元素相对原子质量是指元素的平均原子质量与核素12C原子质量的1/12之比,以前称为原子量。
③m0———电子静止质量,1m0=9.108×10-31 kg。
(1)光学性能。在室温下它的禁带宽度为1.12eV,其光的吸收处于红外波段。虽然硅在可见光谱范围内是不透明的,但接近红外光谱频率、1~7μm的红外光是可穿透的。它具有很高的折射系数和极高的反射率,因此被广泛地应用于太阳电池、接近红外光谱频率的光学元件、红外及γ射线的探测器上。
(2)热学性能。硅具有明显的热膨胀及热传导性质。当硅在熔化时其体积会缩小,反之,当硅从液态凝固时其体积会膨胀。在直接单晶收尾结束后,剩余的硅冷却凝固时会导致石英坩埚破裂。由于硅具有较大的表面张力(熔点时张力为835N/m)和较小的密度(固态时为2.33g/cm3)。根据此特性,可采用悬浮区熔技术(FZ)生长晶体,既可避免石英坩埚对硅的沾污,又可进行多次区熔提纯及制备低氧高纯的单晶。
能隙大小随温度变化见图5-1,半导体Si、Ge、GaAs本征载流子浓度n与温度的关系见图5-2。
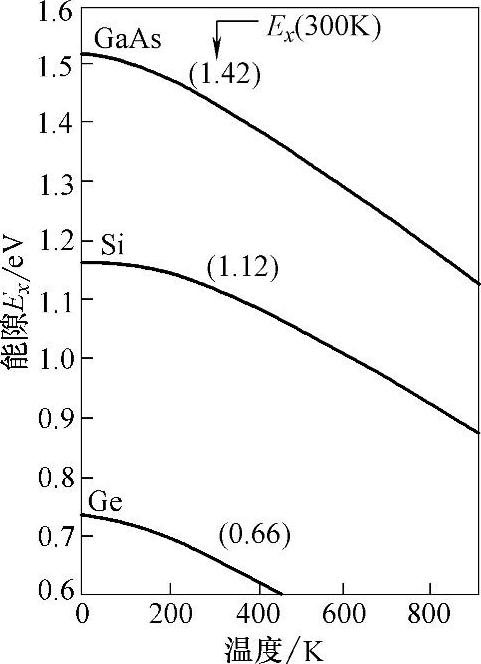
图5-1 半导体Si、Ge、GaAs能隙大小随温度变化
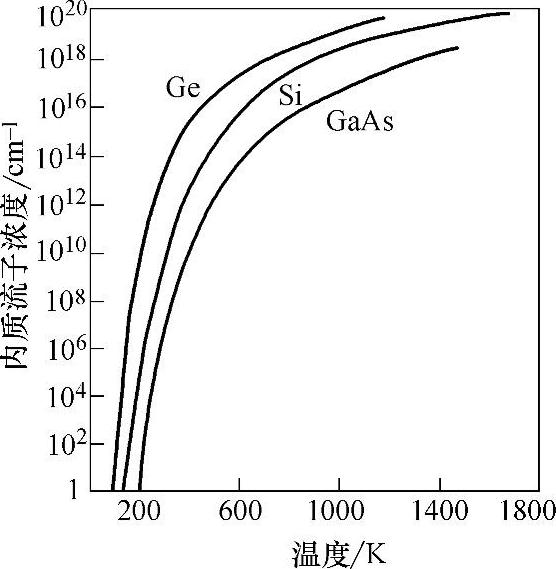
图5-2 半导体Si、Ge、GaAs本征载流子浓度n与温度的关系
(3)力学性能。在室温时,硅是一种无延展性的脆性材料。但在温度高于700℃时,硅却具有明显的热塑性,在应力的作用下会呈现塑性变形。硅的抗拉应力远远大于抗剪应力,故在硅片的加工过程中会产生弯曲和翘曲,也易产生裂纹或破碎。
(4)电学性状。硅材料是应用最广泛的、最重要的元素半导材料,具有其他元素不具有的一些特性,即具有优良的半导体电学性质,本征载流子浓度为1.38×1010个/cm3,载流子迁移率较高,电子迁移率为1900cm2/(V·s),空穴迁移率为500cm2/(V·s),本征电阻率在室温(300K)下高达2.3×105Ω·cm,掺杂后电阻率可控制在104~10-4Ω·cm的宽广范围内,能满足制造各种器件的需要。例如,在硅中掺入亿分之一的硼,其电导率就可降为原来的千分之一。硅单晶的非平衡少数载流子寿命较长,在几十微秒至一毫秒之间,热导率较大。这些优良的半导体电学性质使p-n结具有良好特性,使硅器件具有耐高压、反向漏电流小、效率高、使用寿命长、可靠性好、热传导好,并能在200℃高温下运行等优点。
2.硅的化学性质 硅晶体在常温下化学性质十分稳定,但是在高温时硅几乎可与所有物质发生化学作用。硅极易同氧、氮等物质发生化学反应。它可在400℃时能与氧、在1000℃时能与氮发生化学反应。在采用直拉技术生长晶体的过程中,石英坩埚(SiO2)会与硅熔体发生以下化学反应:

其产物SiO一部分从硅熔体中被蒸发出去,另外一部分却会溶解于硅熔体之中,从而增加了硅中的氧含量,这也是硅中氧的主要来源。因此,在硅晶体的生长过程中,往往采用在真空或低压、高纯惰性气氛(氩气)条件下进行拉晶。硅的一些重要化学反应如下:
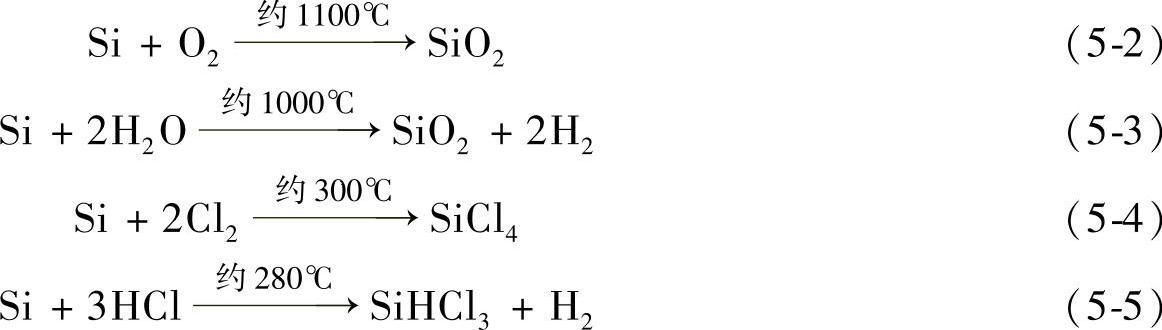
式(5-2)和式(5-3)用于硅IC平面工艺中生成氧化层的热氧化反应,式(5-4)和式(5-5)被用来制备高纯硅的基本材料SiCl4、SiHCl3。由于二氧化硅(SiO2)十分稳定,故使得SiO2膜在IC器件工艺中起着极为重要的作用。
硅对大多数酸是稳定的。硅不溶于HCl、H2SO4、HF、HNO3及王水,但却极易被HNO3-HF的混合酸溶解。因此,在硅片加工及IC器件工艺中,HNO3-HF的混合酸常常用作硅的腐朽液。其反应如下:
Si+4HNO3+6HF=H2SiF6+4NO2+4H2O (5-6)
式(5-6)中,HNO3起着氧化剂的作用,HF不会与硅发生化学反应。
硅的原子价主要为4价,其次为2价。在常温下它的化学性质稳定,不溶于单一的强酸,易溶于碱,易于形成稳定的热氧化膜。在平面型硅器件制造中,可以用氧化膜实现P-N结表面钝化和保护,还可以形成金属-氧化物-半导体结构,制造MOS场效应晶体管和集成电路;在高温下化学性质活泼,能与许多元素化合。
3.硅的晶体结构 常见的元素半导体和二元化合物半导体的晶体结构,主要有金钢石型、闪锌矿型、纤锌矿型。硅属于金钢石型。图5-3示出半导体材料主要晶体结构。
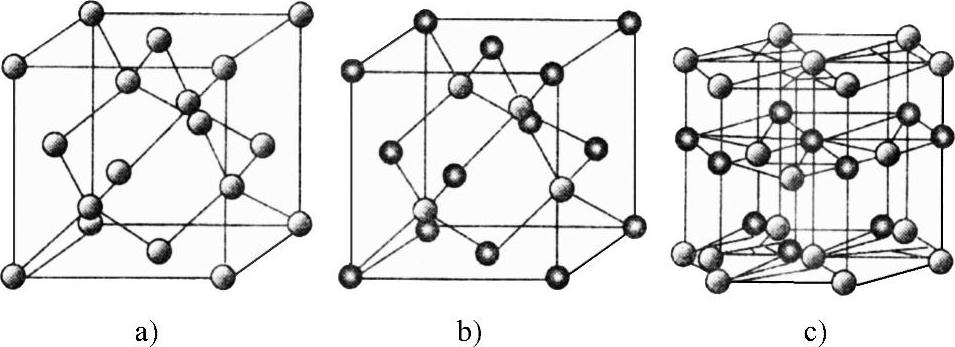
图5-3 半导体材料主要晶体结构
a)金刚石型 b)闪锌矿型 c)纤锌矿型
硅晶体结构是面心立方晶胞,两套同种元素晶胞套构形成金钢石型;闪锌矿型是由两套不同种元素晶胞套构形成。图5-4示出面心立方晶胞与晶体结构关系。这些晶体结构是周期性重复的。
硅晶体中原子以共价键结合,每个硅原子带有四个共价键,有8个电子。每个原子最邻近的四个键合原子,是位于该原子为中心的正四面体角落上,其相邻两个原子的间距是 ,四面体的共价半径为
,四面体的共价半径为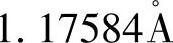 。故可估算出硅晶格中仅有约34%的体积为原子所占有,为此硅晶体这种松散结构中可填入相当多的杂质原子。
。故可估算出硅晶格中仅有约34%的体积为原子所占有,为此硅晶体这种松散结构中可填入相当多的杂质原子。
不论晶体属于任何结构,它都不是完全对称的,表现出各向异性的特征。各向异性特征的表示符号有:{hkl}、(hkl)、<mnp﹥、[mnp]。
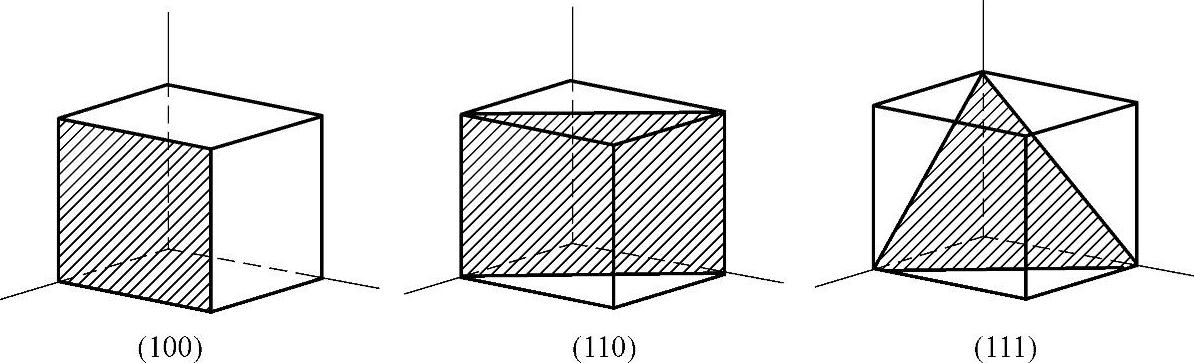
(1)晶面。用(hkl)表示晶面,{hkl}表示晶面族,h、k、l称为密勒指数,也称为晶面指数,是指一个不通过原点的晶面,该晶面在x、y、z三个晶轴上的截距的倒数的互质数为h、k、l。由于金钢石型结构的对称性,每一类型的晶面组有着相同的面间距、面密度和质点分布,这种面称为等同晶面。在立方体系中,每一个晶面都是一个晶面族:{111}含有8个等同晶面,{110}含有12个等同晶面,{100}含有6个等同晶面。图5-5示出晶面指数。
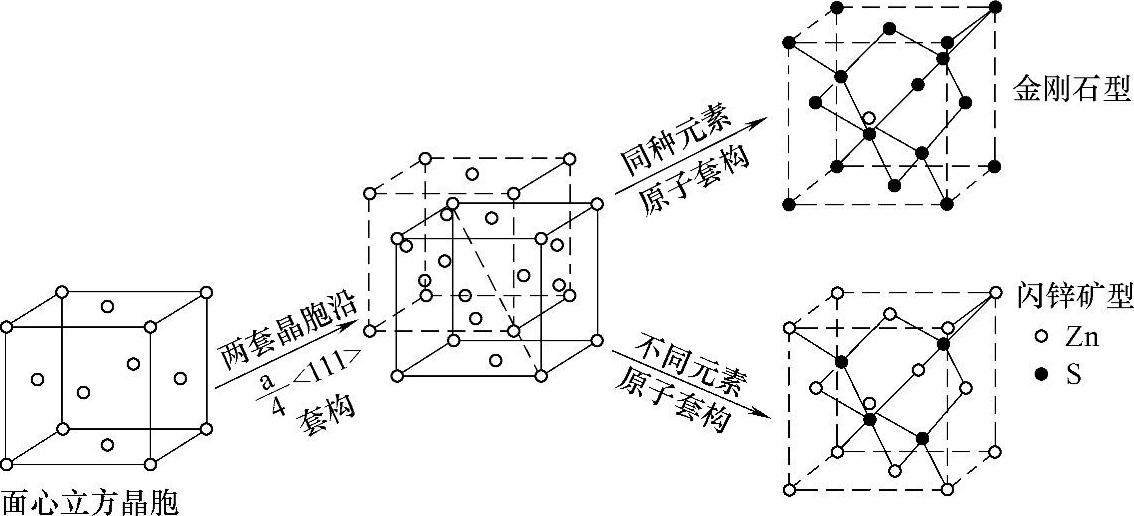
图5-4 面心立方晶胞与晶体结构关系
 (https://www.xing528.com)
(https://www.xing528.com)
图5-5 晶面指数
晶面指数分别为
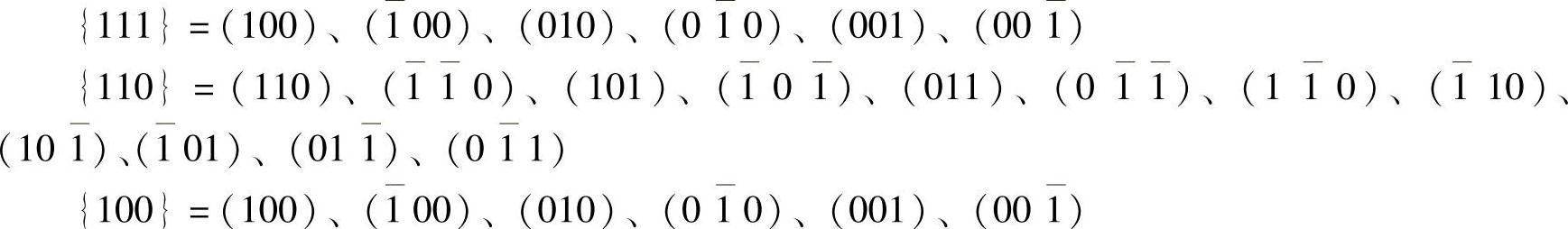
“1”表示与“1”方向相反。
{111}面间距最大,键密度最小,在间距大的面上的键密度又最小。而{110}次之,因此它们之间的结合力最弱,最容易由此断开,这种断裂现象称为“解理”。利用“解理”可把大晶片分割成小芯片。硅晶体{111}和{110}是主要解理面和次要解理面。
(2)晶向。这是指晶列组的排列方向,用[mnp]表示晶向,<mnp﹥表示等同晶列组。m、n、p称为晶向指数。确定晶向指数的方法:选一格点为点O,令坐标轴与晶轴重合,选择或平移操作通过原点O的晶列,任取晶列上一点A作矢量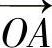 ,表示为
,表示为
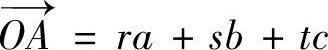
用r、s、t的最大公约数去除,使之成为互质的整数m、n、p。用方括号[mnp]表示,就是该晶列的晶向指数。图5-6示出晶向指数。
在一些晶体中,有些晶列组是不同的,但是它们有相同的结点间距和质点分布,这些晶列组称为等同晶列组,其方向用符号<mnp﹥标记。硅晶体有几个重要的等同晶列组,<111﹥有8个晶向,<110﹥有12个晶向,<100﹥有6个晶向。分别为
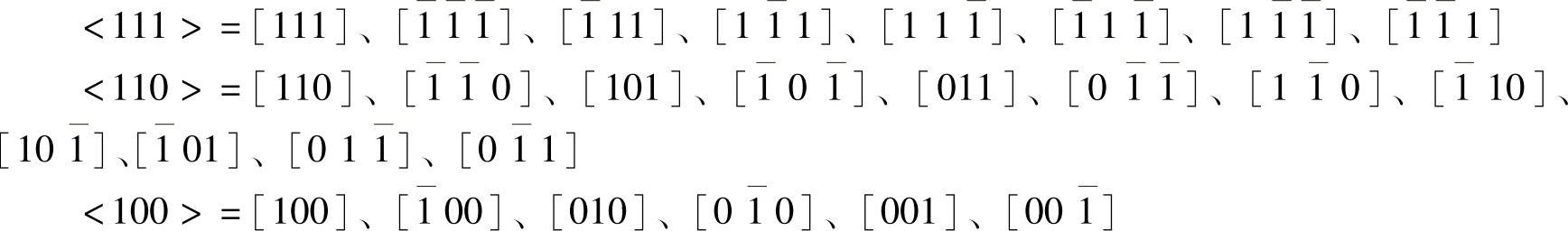
“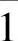 ”表示与“1”方向相反。
”表示与“1”方向相反。
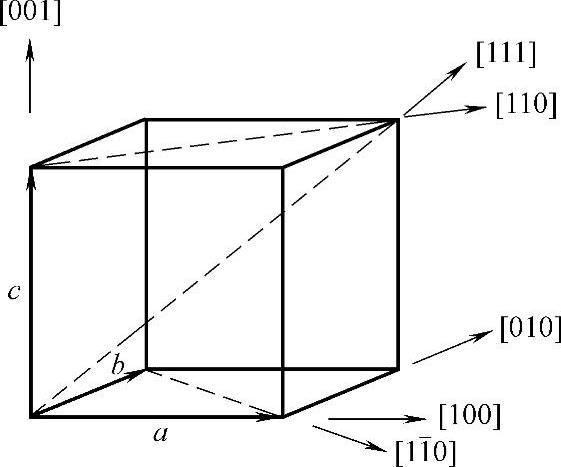
图5-6 晶向指数
金刚石型晶体结构中最密堆积系统是(111)晶面和[110]晶向。因此在晶体生长过程中,{111}面是生长速率最慢的结晶面,所以硅晶体的优先生长是以{111}面为边界的八面体,如图5-7所示。
[110]方向的硅单晶具有4重轴对称性,而[111]方向的硅单晶则具有6重轴对称性。其极球平面投影如图5-8所示。
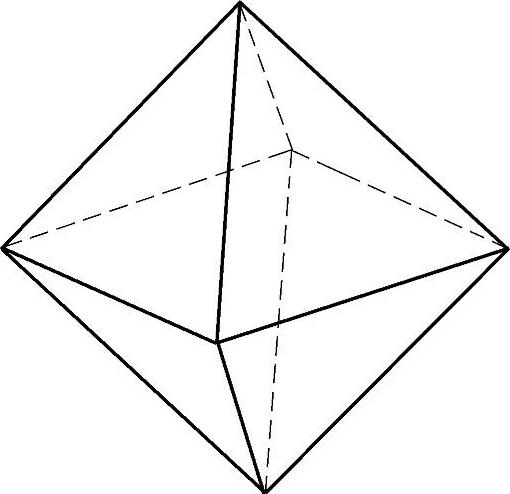
图5-7 硅单晶八面体
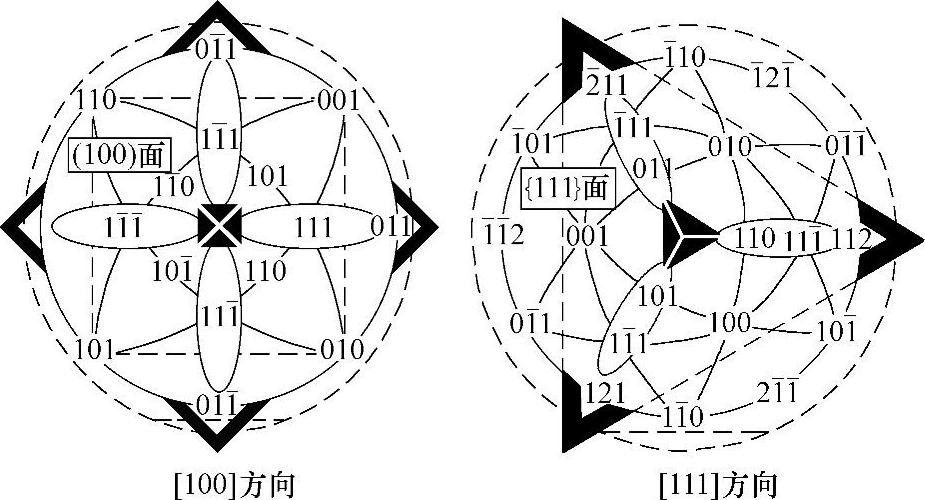
图5-8 硅单晶在[110]、[111]方向的极球平面投影
(3)硅键。硅具有金刚石型晶体结构,每个原子与相邻近的四个原子结成键,如图5-9所示。
硅原子的最外层轨道具有四个价电子,它可与四个相邻近原子分享其价电子,所以这样的一对共享价电子称为共价键。在室温时,这些共价电子被局限在共价键上,故不能像金属具有可以导电的自由电子。但是在比较高的温度下,热振动可能把共价键打断。当一个共价键打断时,即可释放出一个自由电子参与导电行为。因此半导体在室温时的电性如同绝缘体,但是在高温时的电性如同导体一样具有高的导电性。每当半导体释放出一个价电子时,便会在共价键上留下一个空位。完整的共价键与破断的共价键对比如图5-10所示。
这个空位又可能被邻近的价电子所填补,因而导致空位位置不断移动。为此,把空位视为类似于电子的一种粒子,称为空穴。空穴带着正电,在外加电场下与电子相反的方向移动。当硅中掺入以施主杂质(V族元素:磷P、砷As、锑Sb等)为主时,以电子导电为主,成为n型硅。当硅中掺入以受主杂质(Ⅲ族元素:硼B、铝Al、镓Ga等)为主时,以空穴导电为主,成为p型硅。硅中p型和n型之间的界面形成p-n结。图5-11示出硅中掺入杂质。
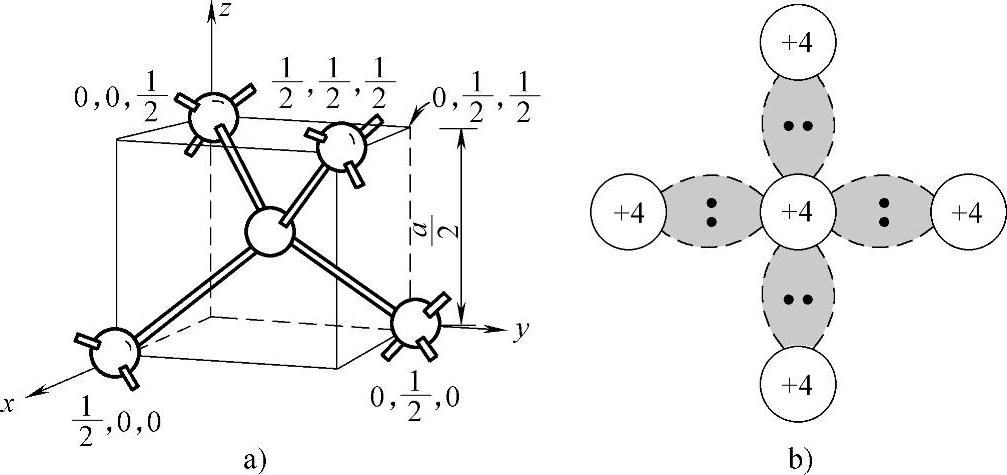
图5-9 硅键
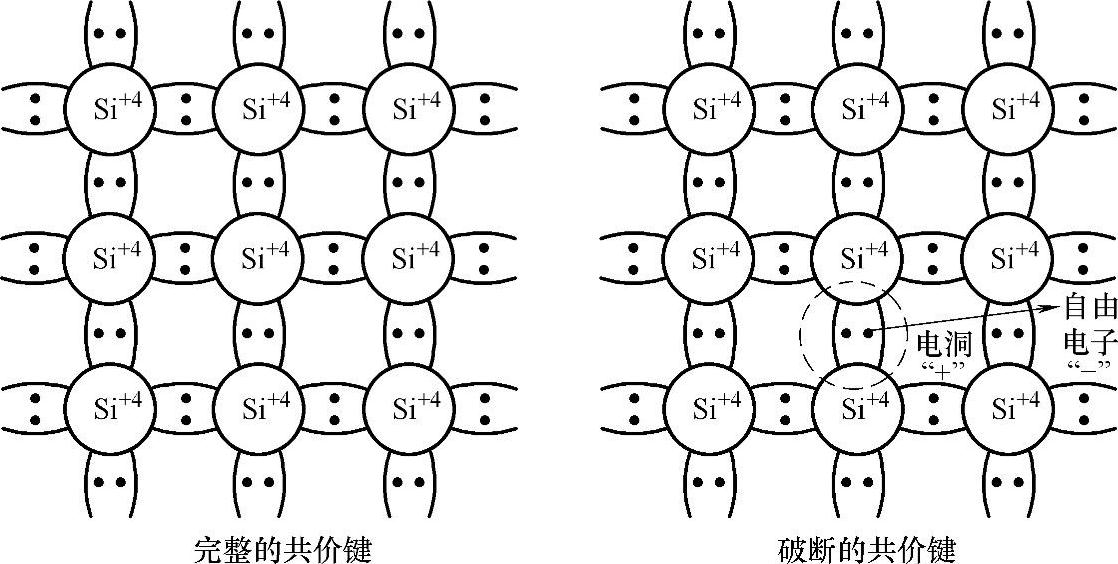
图5-10 破断的共价键
硅中有很多杂质,这些金属杂质(重金属、过渡金属)会形成多个杂质能级,起到复合中心的作用,导致少子寿命降低,因此要去除杂质。但考虑提纯成本,只要少量杂质的存在不对器件造成影响,就允许其存在。图5-12示出杂质元素在硅能隙中占有的能带位置。
4.分类 硅材料有多种形态,按晶体结构可分为单晶硅、多晶硅和非晶硅。单晶硅材料是指硅原子在三维空间有规律周期性的不间断排列,形成一个完整的晶体材料,其材料性质体现各向异性,即在不同的晶体方向各种性质都存在差异。多晶硅材料是指由两个以上尺寸不同的单晶硅组成的硅材料,其材料性质体现的是各向同性。非晶硅材料是指硅原子在短距离内有序排列、而在长距离内无序排列的硅材料,其材料的性质显示各向同性。
(1)单晶硅
1)优点。单晶硅太阳电池的结晶十分完整,自由电子与空穴在内部的移动不会受到阻碍,不容易发生自由电子与空穴复合的情况,所以单晶硅太阳电池效率高。此外,完整的结晶使得硅原子与硅原子之间的化学键非常坚固,不容易因为紫外线破坏化学键而产生悬浮键。悬浮键的存在会阻碍自由电子的移动,甚至捕获自由电子造成电流下降。因此完整的结晶不但使单晶硅太阳电池光电转换效率高,同时也使得光电转换效率不易随时间衰退。
2)缺点。其价格贵。
(2)多晶硅
1)优点。其成本低
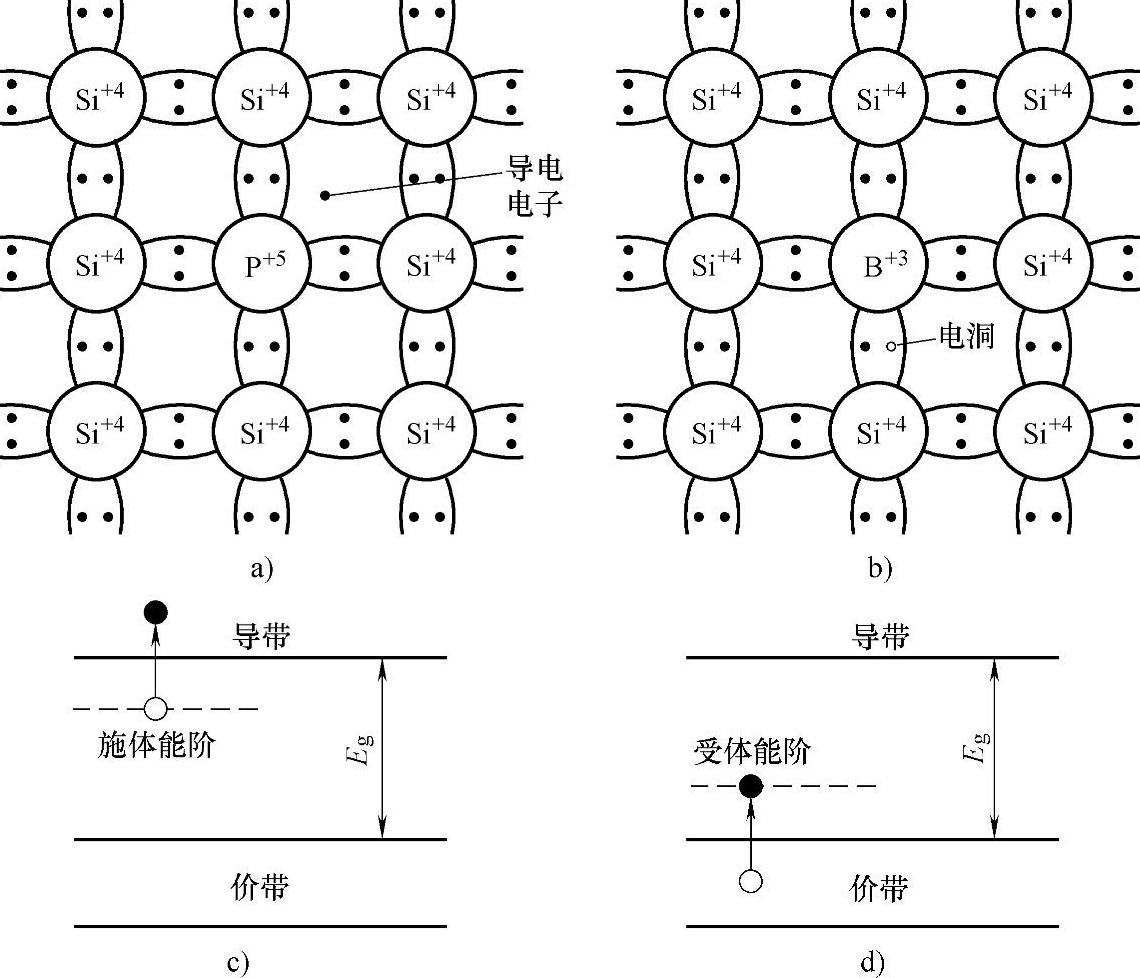
图5-11 硅中掺入杂质
a)n型杂质(磷) b)p型杂质(硼) c)n型半导体 d)p型半导体
2)缺点。多晶硅在纯化过程中,没有将杂质完全去除;快速结晶,硅原子没有足够的时间形成单一晶格而形成许多结晶颗粒。如果结晶颗粒越大,则效率与单晶硅太阳电池越接近;结晶颗粒越小,则效率越差。效率差的原因是颗粒与颗粒之间存在着结晶边界,结晶边界存在着许多的悬浮键。悬浮键会与自由电子复合而使电流减少,而且结晶边界的硅原子键情况较差,容易受紫外线破坏而产生更多的悬浮键。随着使用时间的增加,悬浮键的数目也会随着增加,光电转换效率因而逐渐衰退。此外,杂质多半聚集在结晶边界,杂质的存在会使自由电子与空穴不容易移动。
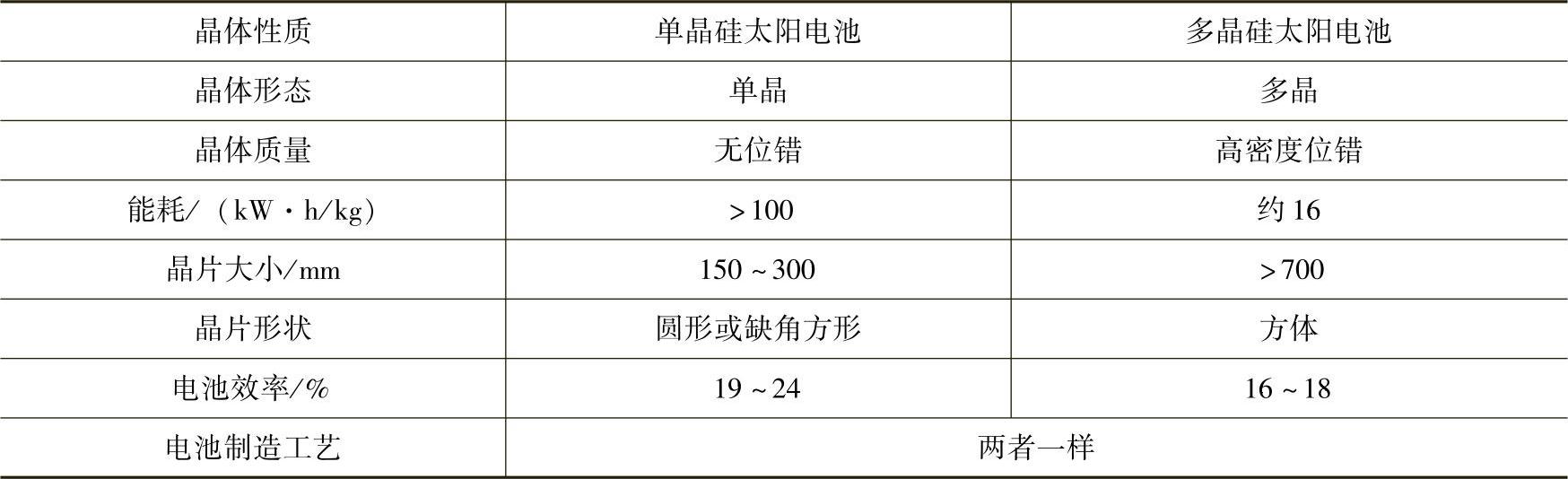
(3)多晶硅与单晶硅的比较。多晶硅太阳电池就是采用多晶硅片制成的太阳电池。即多晶硅不拉制,也不区熔成单晶硅,把高纯多晶硅熔化,先浇铸成方锭,容易做成大面积,然后再切片制成太阳电池。多晶硅太阳电池的缺点是电池片中含有大量的晶粒、晶界、位错,其转换效率低于单晶硅太阳电池。单晶硅需要以高纯的多晶硅为原料来拉制,或通过区熔才能获得,因此,它的工艺路线较长,生产成本较高。单晶硅电池片是圆片或缺角的方片。单晶硅材料的利润率不如多晶硅。表5-2列出单晶硅太阳电池与多晶硅太阳电池比较。
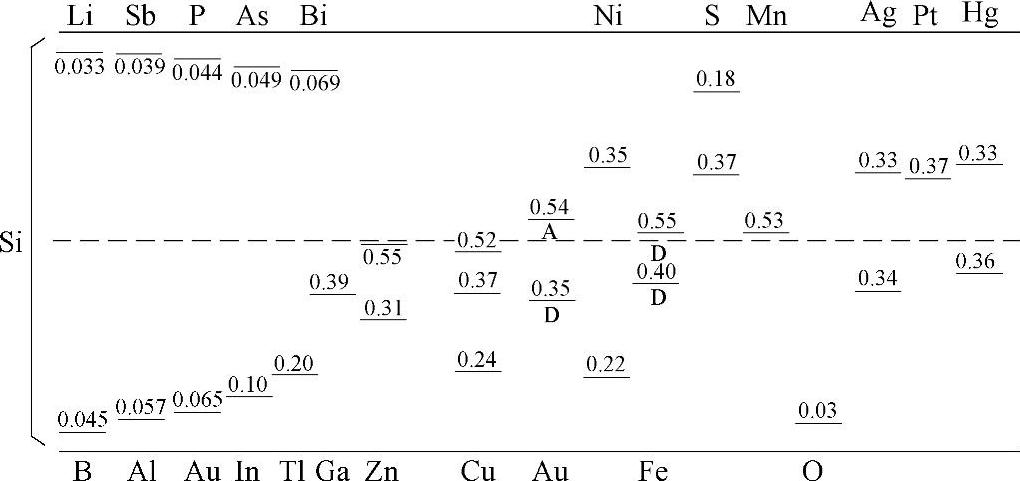
图5-12 杂质元素在硅能隙中占有的能带位置
表5-2单晶硅太阳电池与多晶硅太阳电池比较
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




