在前面讨论的酶反应体系中,酶和底物都处在溶解状态,两者均能自由地扩散,直至碰撞和正确地定向形成酶-底物络合物。然而,在生物体内酶往往与细胞壁和膜相结合,在工业上也可以将酶与不溶解的载体相结合。因此在生物体内和在工业化生产中酶都可以被固定成为不溶解状态。酶从可溶状态转变成固定化状态后,稳定性显著提高。更重要的是,固定化酶应用于食品加工后,酶与反应物可通过离心或过滤等简单快速的分离方法进行分离,反应便于控制调节,产物中不含有酶,也不需要采用热处理等方式使酶失活,酶可反复多次使用,有助于提高食品的质量和降低生产成本。鉴于固定化酶能产生巨大的经济效益,自20世纪60年代以来大量的研究工作集中在这一个领域,并取得很大的发展。20世纪60年代末,日本田边制药公司开发出利用离子吸附结合的L-氨基酸酰化酶拆分外消悬氨基酸衍生物生产L-氨基酸,实现了固定化酶的首次工业应用。20世纪70年代,固定化葡萄糖异构酶转化葡萄糖生产高果糖浆技术成熟,并开始大规模工业化推广应用。
1916年Nelson和Griffin首次发现人工载体氧化铝和焦炭上结合的蔗糖酶仍具有蔗糖酶催化活性,但直到20世纪后半叶,这一发现才被接受,是近代酶固定化技术的基石。1971年在美国召开的第一届国际酶工程会议上正式提出了“固定化酶”(immobilized enzyme)的概念,是指“经物理或化学方法处理,使酶定位在限定的区域,并保持其催化活性,可重复利用的酶”。最初酶的固定化是通过可逆的非共价物理吸附作用将酶吸附在无机载体,如玻璃、矾土或表面包裹疏水化合物的玻璃上。20世纪50年代后,酶的固定化由简单的物理吸附向专一性的离子吸附和共价固定化方向发展,除了使用活性炭、玻璃、高岭土等无机材料作为吸附载体外,天然高分子、CM-纤维素、DEAE-纤维素、交联葡聚糖、琼脂糖以及活性单体聚合制备的高聚物(如氨基聚苯乙烯、聚异氰酸盐)等也可被用作制备固定化酶的载体。从20世纪90年代开始,固定化酶的设计方法变得理性化,通过不同的固定化技术的结合以及使用各种固定化后处理技术提高固定化酶的性能,包括提高比活力,增强固定化酶与底物亲和力以及提高固定化酶的温度和pH稳定性等。
酶的种类很多,可供选择的固定化方法也多种多样。通常需要根据酶的性质、应用目的和应用环境来选择固定化方法。但是无论选择哪种方法一般都要符合以下几点要求:
(1)尽可能地保持自然酶的催化活性。这就要求酶的固定化不能破坏酶活性中心的结构,因此在酶的固定化过程中,要注意酶与载体的结合部位不能是酶的活性部位,以防止活性部位的氨基酸残基发生变化。另外,还要采取温和的条件,尽可能避免酶蛋白高级结构被破坏,以保持酶的活性。
(2)载体应与酶结合牢固,使固定化酶在使用时不容易泄漏,并易于回收及反复使用;其次,载体不能与反应液,产物或废物发生化学反应。另外,载体必须有一定的机械强度,否则固定化酶在连续的自动化生产中会因机械搅拌而破碎。
(3)酶固定化后所产生的空间位阻较小,以避免妨碍酶与底物的接近。
(4)酶固定化的成本要尽可能的低。
归纳起来,酶的固定化方法主要有吸附、共价连接、载体截留和胶囊包合等(图6-26)。下面就这几种方法作简单介绍。
图6-26 酶固定化的主要方法
(一)吸附
吸附固定化酶技术是最早发展起来的酶的固定化方法之一,也是最早应用于工业化过程的固定化酶方法。这类方法是将酶吸附在氧化铝、皂土、纤维素、阴离子(或阳离子)交换树脂、玻璃、羟基磷灰石和高岭土等材料上。
根据吸附剂和酶与载体的吸附力的特点,吸附法又可以分为物理吸附法和离子吸附法。物理吸附法是通过氢键、疏水键等物理作用力将酶固定于不溶性载体上,离子吸附法则是在适宜的pH和离子强度下,利用酶的侧链解离基团和离子交换基团间的离子键作用而达到酶固定化的方法。吸附法固定酶一般不需要添加特殊的化学试剂,方法既省钱又简便,而且酶的构象变化较小或基本不变,对酶的催化活性影响小。然而,由于酶与载体之间的结合力较弱(例如范德华引力、氢键和带相反电荷基团之间的静电引力等),用吸附方法固定酶也有一些缺点。例如,当温度、pH和离子强度改变或当底物存在时,已结合的酶易从载体解吸脱落并污染催化反应产物等。
吸附法中酶与载体间的相互作用可分为以下类型:
(1)非特异性物理吸附 范德华力,氢键,亲水作用。
(2)生物特异性吸附 提供配基的生物吸附。
(3)亲和吸附 对染料或金属的离子吸附。
(4)静电作用 载体与酶电荷之间的相互作用。
(5)疏水作用 载体与酶疏水区域间的作用。
(二)共价连接
酶的共价结合固定化方法是通过共价结合方式将酶固定到一个适当的载体上。酶与载体间的共价结合基于化学反应,即载体表面的活性官能团与酶的活性氨基酸残基之间的反应。由于多点附着作用使得酶构象的空间变化受到限制以及化学修饰导致酶学性质的改变,酶与载体间的共价结合是一种剧烈的固定化方法,具有不可逆性。这类固定酶的方法在实施时包括如下两种不同的处理方式:
(1)采用合适的化学试剂和载体,通过化学反应使酶分子上游离的羧基或氨基等活性非必需侧链基团共价结合到载体上。载体材料包括聚丙烯酰胺、尼龙、纤维素、葡聚糖、交联葡聚糖、硅胶和玻璃珠等。载体使用前必须先活化,活化方法主要有:重氮法、叠氮法、溴化氰法和烷化法等。除游离的羧基和氨基外,酶分子中酪氨酸残基的酚环、半胱氨酸残基的巯基、丝氨酸和苏氨酸残基的羟基、组氨酸残基的咪唑基及色氨酸残基的吲哚基也可以作为官能团参与共价结合。
(2)采用各种双官能试剂或多功能试剂,例如用戊二醛将酶分子连接起来。酶分子通过双官能试剂或多功能试剂彼此相连接,在连接过程中形成了共价键,同时酶的一部分起着载体的作用。除戊二醛外,1,5-二氟-2,4-二硝基苯和二甲基己二酰胺(Dimethyladipamidate)也可以作为共价连接的双官能试剂。
现在更多的是采用双重固定化的吸附交联法。即将吸附作用和交联反应结合起来,首先将酶蛋白吸附到载体上,然后加入交联剂戊二醛,使酶蛋白分子形成网格结构,牢固地附着在载体上。共价键是比较牢固的化学键,因此采用共价连接的方法固定的酶一般不会再泄漏。然而,在操作过程中如何使酶的分子结构,尤其是酶的活性部位经受最低限度的改变是至关紧要的,否则将会导致用此法固定的酶具有较低的活力。
(三)载体截留
采用凝胶(例如聚丙烯酰胺凝胶)包埋将酶分子截留,酶通常会被包埋成网格型。载体截留常用的载体有海藻酸钠凝胶、角叉菜胶、明胶、琼脂凝胶、卡拉胶等天然凝胶以及聚丙烯酰胺、聚乙烯醇和光交联树脂等合成凝胶或树脂。这类固定化酶允许低相对分子质量底物通过扩散自由进入细小的凝胶颗粒,而酶和相对分子质量较大的终产物不能从凝胶颗粒中渗漏出去。该法不涉及酶的构象及酶分子的化学变化,反应条件温和,因而酶活力回收率较高。通过载体截留法制备的固定化酶易泄漏,常存在扩散限制、催化反应受传质阻力的影响等问题,而且不宜催化大分子和不溶性底物的反应,在食品工业中的使用受到相当大的限制。
(四)胶囊包埋
胶囊包埋法制备固定化酶类似于载体截留法,但是它不是形成凝胶,而是形成很小的颗粒或胶囊。胶囊包埋法是将酶包埋在各种高聚物制成的半透膜微胶囊内的方法。它使酶存在于类似细胞内的环境中,可以防止酶的脱落以及与微胶囊外的环境直接接触,从而增加了酶的稳定性。常用于制造微胶囊的材料有聚酰胺、火棉胶、醋酸纤维素等。用微胶囊包埋法制得的微囊型固定化酶的直径通常为几微米到几百微米,胶囊孔径为几埃至几百埃,适合于以小分子为底物和产物的酶的固定化,如:脲酶、天冬酰胺酶、尿酸酶、过氧化氢酶等。
(五)其他固定化方法
研究开发新型酶固定化方法的原则是:在较为温和的条件下进行酶的固定化,尽量减少或避免酶活力的损失。辐射、光、等离子体、电子(导电载体)等新方法均可用于制备高活性固定化酶。近年来,新型固定化方法不断出现,概括起来主要包括新型载体固定化酶技术、无载体固定化酶技术以及定向固定化酶技术等。
1.新型载体固定化酶技术
(1)辐射处理固定法 辐射技术也在固定化酶领域得到应用,γ-射线引发丙烯醛与聚乙烯膜接枝聚合后,活性醛基可共价固定化葡萄糖氧化酶,并呈现出良好的结果;60Co辐照冰冻态水溶性单体与酶的水溶液混合体时,可使单体聚合与酶固定化同步完成。当回到常温时,因冰融化而形成的多孔结构非常有利于底物与产物的扩散,并可提高酶的活性;此外,以137Cs为辐射源,通过γ-射线引发将甲基丙烯酸甲酯接枝共聚于尼龙膜表面,该载体经进一步活化,可用于青霉素酰化酶的固定。类似的利用辐射处理制备固定化酶的报道还有很多。
(2)光化学固定法 光偶联法是以光敏性单体聚合物包埋制备固定化酶或带光敏性基团的载体共价固定酶的方法。由于条件温和,该法可获得酶活力较高的固定化酶。例如,利用含芳香叠氮基的光活性酯,在远紫外光辐照下,叠氮基光解生成氮烯与PES膜表面的C—H键间发生插入反应形成仲胺,将脲酶共价键合到PES膜的表面。光化学固定化方法为酶及其他生物分子的固定化提供了一条新的途径。
(3)等离子体固定法 等离子体是高度激发的原子、分子、离子以及自由基的聚集体,大量的等离子体通常在室温下存在。运用等离子体聚合或表面处理技术改变载体材料的表面性质,进而固定酶蛋白的方法主要有4类:等离子体表面处理、等离子体聚合、等离子体接枝共聚和等离子体化学气相沉积。等离子体表面处理是用等离子体处理载体使载体材料表面形成一定数量的活性基团,如羟基、羧基、胺基等,然后通过这些活性基团或者这些活性基团的衍生物对酶进行固定化。另外,等离子体对载体材料的表面处理也可改变载体的吸附性能,从而利用物理吸附来固定化酶。等离子体聚合是利用离子体放电产生的自由基引发溶液聚合。将酶和有机单体混合后进行等离子体聚合反应,聚合后酶蛋白被包裹在其中。也有研究者提出先将蛋白物理吸附在载体表面,再用等离子体放电处理,将酶蛋白直接“键合”在载体表面。等离子体接枝共聚是指先对材料进行等离子体处理,利用表面产生的活性自由基引发具有功能性的单体在材料表面进行接枝共聚,进而固定化酶。用这种方法制备固定化酶的效果较好,因此越来越受到重视。等离子体化学气相沉积技术是气态物质在低温等离子体中发生化学反应,在基体上生成新固体薄膜的方法。
(4)电化学聚合固定法 电聚合物作为酶固定化载体时,特别有利于酶电极类生物传感器的制备。有研究报道,用电化学聚合法制备聚苯胺膜,并通过静电吸附固定辣根过氧化物酶(HRP),形成聚苯胺修饰的HRP电极,聚苯胺在电极与酶分子之间传递电荷。这种酶电极对H2O2的电流响应高达25A,响应时间小于15s。相比于未复合纳米金胶传感器,该传感器具有更高的稳定性,更低的检测下限。Rajesh等合成了聚(N-3-氨丙基吡咯-吡咯)(PAPCP)导电多孔膜,共价固定脲酶(Urs)后用作定量检测尿素的生物传感器。该传感器敏感度高、反应时间短、酶活性保持良好。
2.无载体固定化酶技术
在载体固定化酶中,由于聚合物载体的存在而大大降低了酶与大分子底物的结合容量和反应能力,而无载体固定化酶具有较高的催化剂比表面、较高的酶催化活性、受底物扩散限制的影响较小、成本低等优点。另外,一些无载体固定化酶技术还可提高酶在极端条件下及在有机溶剂及蛋白酶中的操作稳定性。目前无载体固定化酶技术(图6-27)主要有如下几种:
(1)交联溶解酶技术 交联溶解酶(Cross-Linked Dissolved Enzyme,CLDEs)是通过交联剂对酶分子直接交联而获得的。到目前为止,已有20多种酶通过交联直接形成交联溶解酶或先吸附在惰性膜载体上再经交联形成有载体的交联溶解酶。
(2)交联酶晶体技术 交联酶晶体(Cross-Linked Enzyme Crystals,CLECs)是近年来发展起来的新型酶晶体催化剂,是酶结晶技术和化学交联技术的结合。目前,已经有10余种CLECs实现了商品化。
(3)交联酶聚集体技术 交联酶聚集体(Cross-Linked Enzyme Aggregate,CLEAs)是酶分子经沉淀形成不溶性酶聚集体再经交联反应得到的。大量研究表明,各种酶的交联酶聚集体在适当的反应条件下都会显示出较好的催化活性和反应稳定性。
(4)交联喷雾干燥酶技术 尽管喷雾干燥酶颗粒可以获得较好的酶活,但直到今天还未开发出理想的交联喷雾干燥酶(Cross-Linked Spray-dried Enzyme,CLSDs)。主要原因是喷雾干燥容易导致酶失活。另外,与交联酶晶体、交联酶聚集体或有载体固定化酶相比,交联喷雾干燥酶的操作性相对较差,故而其工业应用受到限制。
图6-27 无载体固定化酶技术的几种形式
3.定向固定化酶技术
定向固定化酶技术是在酶的特定位点直接或者间接地与载体结合,酶活性位点位于载体外侧,天然构象基本保持不变,有利于底物进入到酶的活性位点,从而显著提高固定化酶的活力。定向固定化酶技术因其较高的活力、良好的稳定性以及保持酶的天然构象等优点而吸引着越来越多研究者的关注。但是定向固定化酶技术仍处于实验研究阶段,并没有在工业生产中大规模应用。随着研究的逐渐深入,定向固定化酶技术将在生物芯片、生物传感器、生物反应器、临床诊断、药物设计、亲和层析以及蛋白质结构和功能的研究中得到越来越多的应用。(https://www.xing528.com)
目前已报道的关于酶的定向固定化方法按照作用力可分为非共价定向固定和共价定向固定。非共价作用力主要是抗体与抗原,亲和素/链霉亲和素与生物素以及组氨酸标签与Co2+/Ni2+之间的亲和作用;共价定向固定主要是通过半胱氨酸残基上的巯基与载体直接或间接作用。按照作用形式又可细分为位点专一性共价定向固定化,抗体偶联的定向固定化,利用糖蛋白糖基的定向固定化以及利用基因工程的方法实现定向固定化(包括:特定位点突变法以及亲和标签介导的定向固定化)等。
载体作为固定化酶技术的重要组成部分,其结构及性能在很大程度上直接影响着所得固定化酶的催化活性及操作稳定性。综合性能优良的载体材料的设计与制备是固定化酶技术发展的重要研究领域。
按照固定化方法的不同,固定化酶载体可分成物理吸附载体、共价连接载体、截留载体以及胶囊包埋载体等。根据载体材料的组成又可将固定化酶载体分为高分子载体、无机载体、复合载体和新型载体等。常见的无机物理吸附载体有活性炭、高岭土、氧化铝、硅胶、微孔玻璃、多孔陶瓷等,有机物理吸附载体有纤维、火棉胶等。离子交换吸附载体有CMC、DEAE-纤维素、DEAE-葡聚糖凝胶等。共价连接载体有聚丙烯酰胺、氨基酸共聚物、甲基丙烯醇共聚物等。截留载体有海藻酸钠凝胶、角叉菜胶、明胶、琼脂凝胶、卡拉胶等天然凝胶以及聚丙烯酰胺、聚乙烯醇和光交联树脂等合成凝胶或树脂等。胶囊包埋载体有聚酰胺、火棉胶、醋酸纤维素等。
随着对固定化酶研究的不断深入,磁性载体、纳米材料载体、环境敏感性载体以及导电载体等新型载体材料逐渐成为今后固定化酶载体研究的主要方向。
磁性载体主要是指磁性高分子微球,即内部含有磁性金属或金属氧化物(如铁、钴、镍及其氧化物)的超细粉末而具有磁响应性的高分子微球,可以借助外部磁场从反应体系中快速简便地富集、分离和回收固定化酶,从而可以随时控制酶促反应的进行,提高酶的使用效率。
纳米材料载体主要有金纳米粒、胶体金、氧化铝纳米粒等,可以给酶分子提供良好稳定的微环境。高分子纳米材料与酶的固定化方式主要有3种,外移置法、内移植法和自组装法。尽管纳米材料固定化酶的研究还处于初级阶段,但由于它可保持酶的稳定性和适合于大规模应用,所以这种固定化酶方法具有很大的应用前景。
近年来,开始有将环境敏感性载体用作固定化酶载体的报道。环境敏感性载体固定的酶可以通过调节反应体系的温度或pH来实现均相催化和异相分离的目的。但是,这类温度或pH敏感性载体材料也存在一定的局限性,即对于一些对温度或pH十分敏感的酶,这类载体不适用。随着研究的不断深入,光敏感、压力敏感及离子强度敏感等环境敏感性材料也可能成为新型固定化酶载体。
此外,导电载体作为固定化酶的一类特殊载体,在基于酶电极的生物传感器领域得到了广泛应用,极大地推动了酶生物传感器的发展。导电载体材料主要包括两类,即导电高聚物载体和导电复合载体,前者一般是具有共轭结构和导电能力的有机聚合物,如聚苯胺(PAn)、聚噻吩(PTh)、聚吡咯(PPy)及其衍生物等,后者则是在导电材料中复合一些特殊物质而制得的导电复合载体。
当酶被固定时,一些额外的因素能影响酶-底物络合物的形成和酶-底物络合物转变成产物的过程。这些因素包括:①酶已被固定,仅底物能自由扩散;②酶的载体被Nernst扩散层所包围,后者的作用像一个边界,使得靠近酶的底物浓度低于体相的底物浓度;③由于酶、底物和载体都可能带有电荷,因此产生静电因子,它可能增强底物与酶的结合(底物与载体带有相反的电荷),也可能削弱底物与酶的结合(底物与载体带有相同的电荷);④当期望达到最高的底物转变成产物的速度时,反应初速度v0已不再适用。
Hornby等考虑到上述因素①~③推出了一个适合于固定化酶反应的动力学方程式。采用流动柱状反应器时,固定化酶的反应速度按下式进行计算。
式中  —表观米氏常数;
—表观米氏常数;
X—Nernst扩散层厚度;
D—底物的扩散系数;
T—温度,K;
Z—底物的价数;
F—Faraday常数;
R—通用气体常数;
V—载体附近的电位梯度。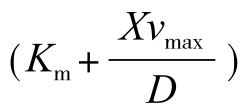 被称为扩散项。严格地说,Km和vmax不是扩散参数,而X和D是扩散参数。
被称为扩散项。严格地说,Km和vmax不是扩散参数,而X和D是扩散参数。 被称为静电项,这是因为此项中含有Z、F和V。分析扩散项可以看出,
被称为静电项,这是因为此项中含有Z、F和V。分析扩散项可以看出,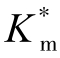 随X/D减小而降低,并且逼近Km。采用较小的载体或提高流动速度(或搅拌速度)可使X(扩散层厚度)减小。D与反应体系的组成有关。分析静电项可以看出,如果Z和V具有相同符号,即底物和载体具有相同的电荷,那么
随X/D减小而降低,并且逼近Km。采用较小的载体或提高流动速度(或搅拌速度)可使X(扩散层厚度)减小。D与反应体系的组成有关。分析静电项可以看出,如果Z和V具有相同符号,即底物和载体具有相同的电荷,那么 这一项大于1,使
这一项大于1,使 增大;如果Z和V具有相反的符号,那么静电项小于1,使
增大;如果Z和V具有相反的符号,那么静电项小于1,使 减小;如果Z或V=0,那么静电项等于1,
减小;如果Z或V=0,那么静电项等于1, 仅受扩散因素影响。
仅受扩散因素影响。
在流动柱状反应器中固定化酶催化的反应的速度v,不再是v0。在实际操作中,总是期望底物尽可能多地转变成产物。在反应器中反应可以遵循0级、混合级或一级速度动力学,这取决于反应的时间。因此,可用下式描述柱状反应器中的动力学过程。
式中 k2—速度常数;
[E]0—酶的总浓度;
t—底物在反应器中停留的时间;
[S]0—底物初始浓度;
[S]t—时间t时底物的浓度;
 —表观米氏常数。
—表观米氏常数。
在时间t时底物S转变成产物P的分数由式(6-45)表示
底物S通过反应器所需时间t=v0/Q,v0是柱状反应器的空体积,Q是底物通过反应器时的流速。将底物在反应器中停留的时间t和底物转变成产物的分数F的表达式代入式(6-45)并经变换得到式(6-46)
式(6-46)是一个线性方程,y=[S]0F和X=ln(1-F),而直线的斜率=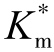 。
。
Lilly和Sharp推导出一个能适用于连续进料搅拌式反应器的固定化酶反应动力学方式
鉴于固定化酶的诸多优点,近几十年来国内外研究工作者为固定化酶技术的发展和工业化应用做出了巨大的努力。然而,到目前为止仅有少数几种固定化酶被应用于大规模工业生产。
固定化氨基酰化酶是世界上第一种工业化生产的固定化酶。1969年日本田边制药公司将从米曲霉中提取分离得到的氨基酰化酶,用DEAE-葡聚糖凝胶为载体通过离子键合法制成固定化酶。DL-甲硫氨酸先经过乙酸酐酰化处理,生成乙酰-DL-甲硫氨酸,然后用立体选择性酶—固定化氨基酰化酶,进行拆分,拆分液进行分离得到L-甲硫氨酸和乙酰-D-甲硫氨酸,乙酰-D-甲硫氨酸再经过消旋处理进行重新拆分,不断得到L-甲硫基酸,这样L-甲硫氨酸的总收率得到很大的提高(图6-28)。使用固定化氨基酰化酶的生产成本仅为使用游离酶的生产成本的60%左右。
图6-28 L-甲硫氨酸生产工艺流程
固定化葡萄糖异构酶是目前世界上生产规模最大的一种固定化酶。1973年,美国成功地将固定化葡萄糖异构酶用于工业化生产高果糖玉米糖浆(HFCS)。1967年美国的克林顿玉米加工公司(Clinton Corn Processing Co.CCP)引进日本技术,形成日产400t糖浆的规模,生产含果糖15%的果葡糖浆,首次实现了工业化的果葡糖浆酶法生产。1969年该公司研制出含42%果糖的果葡糖浆。
从淀粉生产高果糖玉米糖浆包括以下几个酶作用阶段:
生产葡萄糖异构酶的菌种主要有链霉菌(Streptomyces sp.)、凝结芽孢杆菌(Bacillus coagulans)、放线菌(Actinoplanesmissouriensis)和节杆菌(Arthrobacter sp.)。葡萄糖异构酶被固定在DEAE—纤维素或多孔的陶瓷载体上,得到的固定化葡萄糖异构酶具有不可压缩的特性,已被应用在大规模的柱状反应器中连续催化异构葡萄糖生产高果糖玉米糖浆。当操作温度为50℃时,葡萄糖异构酶催化葡萄糖异构成果糖反应的平衡常数接近1,因此,在产品中果糖和葡萄糖的浓度大致相等。
L-天冬氨酸和L-苹果酸都可以采用固定化酶以富马酸(延胡索酸)为原料而制备得到。固定化延胡索酸酶(Fumarase)可将富马酸转化为L-苹果酸,而由大肠杆菌得到的天门冬氨酸酶则可催化富马酸与氨作用,得到L-天冬氨酸。这两种酶都是胞内酶,当对细胞进行固定化处理时,酶的稳定性提高了。1974年,用聚丙烯酰胺凝胶包埋含有延胡索酸酶的产氨短杆菌菌体,得到固定化延胡索酸酶在工业上用于转化延胡索酸生产L-苹果酸。1977年以后,改用角叉菜胶包埋具有高活力延胡索酸酶的黄色短杆菌菌体,其L-苹果酸的产率比前者提高了5倍左右。延胡索酸酶和L-天冬氨酸酶催化的反应和产物如下:
低聚果糖(Fructo oligosaccharides,简称FOS)又称蔗果低聚糖,是由1~3个果糖基通过β-2,1-糖苷键与蔗糖中的果糖基结合生成的蔗果三糖、蔗果四糖和蔗果五糖等的混合物。低聚果糖可以通过果糖转移酶作用蔗糖来生产。果糖转移酶的催化作用分两步进行:第一步形成酶-果糖复合物,释出葡萄糖;第二步该复合物将果糖转移给水或蔗糖生成果糖或三糖。目前,用于低聚果糖生产的固定化酶技术主要有三种:一是固定化果糖转移酶法,二是固定化含果糖转移酶细胞或菌丝体法,三是共固定化含果糖转移酶的菌丝体与葡萄糖氧化酶法。第三种方法是先用戊二醛和单宁在20℃条件下将葡萄糖氧化酶与黑曲霉的菌丝体交联4h,然后用海藻酸钙包埋。得到的共固定化细胞颗粒作用于浓度为625g/L的蔗糖溶液,在50℃、pH5.0的条件下反应24h,可以得到低聚果糖纯度为71%(对总糖)的低聚果糖溶液。
在食品工业中固定化酶成功应用的实例还在不断增加。例如,固定化木瓜蛋白酶用于改善啤酒的品质,固定化青霉素酰化酶用于合成6-氨基青霉烷酸(6-APA),固定化乳糖酶用于水解牛乳中的乳糖,以及固定化柚皮苷酶用于减少柑橘类果汁中的柚皮苷含量,从而脱去柑橘类果汁中的苦味等。
另外,固定化酶在医药行业也得到应用。例如,将针对靶细胞的单克隆抗体与酶蛋白药物化学交联固定化,制备得到具有主动靶向性的导向药物。该药物可以直接作用于靶细胞起到杀伤作用,同时能大量减少对非靶细胞的伤害,还可以做成“人工脏器”参与体外循环。
在分析检测领域,灵敏度高,专一性强的固定化酶传感器和固定化酶柱检测器的研发和应用已经取得重要进展。目前已经开发出葡萄糖酶电极、胆固醇电极、尿素电极等,并成功应用于临床血样的分析。此外酶联免疫测定(ELISA)通过抗原与抗体的特异反应将待测物与酶连接,然后通过酶与底物产生颜色反应,用于定量测定。
固定化酶技术的研究尚处于发展阶段,新的载体、新的固定化技术尚在开发、新的应用领域还在不断的拓宽。与此同时,固定化微生物细胞也愈来愈普遍地被应用于食品工业,限于篇幅,本书不作细述,有兴趣的读者可参阅有关的研究论文和专著。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




