第六节 生物靶向药物在腹盆部肿瘤中的应用与放射增敏
传统的抗肿瘤药物治疗是根据不同的药物作用于细胞周期的不同阶段,即G0、G1、M、S期。正常的细胞也存在同样的细胞周期,所以我们传统的药物不仅针对肿瘤细胞产生直接的杀伤力,同时对正常细胞也有影响,因而可谓是双刃剑。近20年来,人类对肿瘤细胞生物学和遗传学的认识有了较大的发展,对癌基因、抑癌基因、细胞凋亡、肿瘤血管形成等的研究也由细胞生物学水平转变到分子生物学水平,许多新的概念包括信号转导、细胞周期、DNA修复等已经得到临床验证。因此,大量以肿瘤细胞水平表达为靶点的新的抗肿瘤药物不断问世,并逐渐走向临床,它主要包括细胞信号转导分子抑制剂、新生血管抑制剂、靶向端粒酶抑制剂以及针对肿瘤耐药的逆转剂。攻击肿瘤的靶点有多方面,目前研究较成熟的主要有肿瘤细胞表面的靶点(抗原或抗体),如细胞膜分化相关抗原(CD13、CD20、CD22、CD33、CD52、CD117等),细胞信号转导分子,如表皮生长因子(EGF)及其受体(EGFR)和血管内皮生长因子(VEGF)及其受体上的酪氨酸激酶,以及法尼基转移酶、基质金属蛋白酶等。表2-3所列是目前已从临床前期进入临床的分子靶向治疗。
表2-3 肿瘤靶向治疗的药物及作用位点
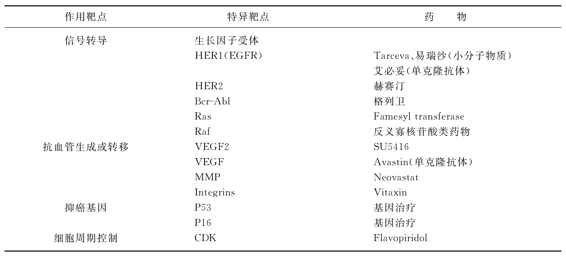
注:EGFR:表皮生长因子受体;Bcr-Abl:融合基因Bcr-Abl;VEGF:血管内皮生长因子;MMP:金属蛋白酶;CDK:cyclin-dependent-kinase,细胞周期依赖激酶。
一、细胞信号转导
(一)概述
信号(包括激素、生长因子及细胞因子)与细胞表面或细胞膜中的受体结合,细胞遂接受分子信号,该信号再通过细胞膜经一系列步骤传递给细胞内分子,后者再活化转录因子。这一系列的信号活动被称为信号转导通路。很多细胞外信号通过诱导细胞内信号转导通路而调控细胞活动,这些通路最终汇聚于一种蛋白激酶上,并常常涉及受体蛋白的磷酸化,后者再磷酸化其他细胞蛋白,化学信号通过数种蛋白磷酸化最终影响转录因子,使细胞内的转录因子活化或失活。所有受体一般都有两个主要部分:①配基结合区(ligand-binding domain),它确保配基的特异性;②效应区(effector domain),它在配基结合受体后启动,产生生物反应。活化了的受体再与其他细胞成分发生作用,以完成信号转导过程。受体激酶就是一组膜结合蛋白(受体蛋白),它有磷酸化能力,可使其他蛋白磷酸化,如受体酪氨酸激酶(PTK)与细胞外配基(ligand)结合后,在膜内二聚化,使激酶磷酸化,后者再使其他蛋白磷酸化,从而启动信号转导通路,影响转录的变化。图2-1为细胞信息转导示意图。
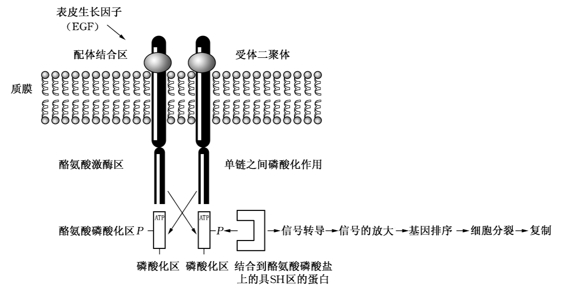
图2-1 细胞信息转导示意图
信号转导(signal transduction)对多细胞机体的细胞生长、分化及各种细胞功能的协调是必需的。从理论上说,影响信号转导通路的任一环节都有可能开发出新抗肿瘤药,如抑制生长因子受体结合、抑制蛋白丝氨酸/苏氨酸激酶、抑制酪氨酸激酶等。近年来正在研发针对信号转导、生长因子及其受体的几种新型药物,并且已经有了重要的成果。
(二)人类表皮生长因子受体家族
近年来,多种人类表皮生长因子受体(human epidermal growth factor receptor,HER/erbB)家族特异性的靶向药物已经进入临床,用于治疗非小细胞肺癌、乳腺癌等恶性实质性肿瘤,并引起了国内外肿瘤界的普遍关注。已知HER家族共有4个成员,分别是HER1(EGFR/erbB1)、HER2(neu/erbB2)、HER3(erbB3)和HER4(erbB4),它们具有高度同源性以及相似的结构——能与特异性的配体结合的细胞外部分、跨膜部分,能将信号转导至下游的细胞内酪氨酸激酶部分,但在能结合的配体及酪氨酸激酶活性上有所差异,HER1/EGFR的配体包括表皮生长因子(epidermal growth factor,EGF)、转化生长因子α(transforming growth factor-α,TGF-α)、二性调节素(amphiregulin)、β-细胞素(betacelluin)、表皮调节素(epiregulin)、结合肝素的EGF样生长因子(heparin-binding EGF-like growth factor)等;HER3/erbB3、HER4/erbB4的配体包括神经调节素(neuregulin)、heregulin、betacellulin等;HER2/neu尚没有已知的配体。HER家族成员通过与特定的配体结合时可形成同源或异源二聚体,在ATP存在的条件下通过细胞内片段的酪氨酸残基的磷酸化,横向转导增殖信号,不同的配体与不同的受体结合,其信号转导通路会有明显差异,借此形成HER受体生物学功能的多样化。
HER活化的主要生物学效应是刺激细胞增殖和分化,当细胞恶变时HER或其配体过表达,从而通过自分泌(autocrine)或旁分泌(paracrine)方式刺激细胞形成失控性增殖,并且启动多种蛋白水解酶和促血管生成因子(如VEGF)的表达,从而加速癌细胞转移。一般来说,HER过表达的肿瘤患者通常预后较差。表2-4所列是FDA已经批准上市的信号转导药物。
表2-4 FDA已批准上市的信号转导药物

注:本章节重点将这些药物在腹部肿瘤中的应用情况作一介绍,其他系统肿瘤的治疗不再赘述。
1.特罗凯(tarceva)(erlotinib,OSI-774) 特罗凯是一种新型的低分子量的喹唑啉(quinazolin)类化合物,是和易瑞沙相似的另一种可口服的表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),可与ATP竞争性结合于EGFR的胞内部分,抑制TPK的活性和磷酸化;特罗凯还可诱导细胞周期抑制蛋白P27的表达,使癌细胞阻滞于G1期,体外实验观察到用药后可诱导癌细胞凋亡的发生。2004年11月18日美国FDA正式批准其上市,用于治疗至少接受过一种化疗方案失败的局部进展期或转移性非小细胞肺癌。
Moore等报道加拿大NCIC-CTG组织的由140个研究中心参加的一项特罗凯联合吉西他滨治疗进展性胰腺癌的Ⅲ期临床(PA3试验)。总共有569例患者随机接受吉西他滨和特罗凯口服,或者单用吉西他滨治疗。结果,与单用吉西他滨组相比,联合组中位生存期明显延长(6.37个月比5.91个月,P=0.034);1年生存率24%比17%,一般状况较好者(PS≤2)效果更好。联合化疗组常见不良反应主要为1/2度皮疹、腹泻和黏膜炎,无论EGFR表达阳性或阴性,联合治疗组的生存率均较高。作者还观察到,有严重皮疹患者的中位生存时间为10.51个月,1年生存率为43%;未出现皮疹者,1年生存率仅20%。该研究证明EGFR抑制剂联合细胞毒药物可提高晚期胰腺癌的生存率,显示吉西他滨联合特罗凯为基础的联合方案具有生存优势,但同时不良反应包括皮疹和腹泻也有一定增多。2005年11月美国FDA已批准吉西他滨联合特罗凯用于晚期胰腺癌作为一线治疗方案。
特罗凯的不良反应主要是皮疹(67%)、腹泻(56%)、皮肤干燥(35%)、瘙痒(35%)、疲劳(28%)、恶心(25%),大多数为轻、中度,有趣的是,其主要不良反应皮疹的发生率与生存期相关,因而另一项关于剂量-皮疹-生存率的试验已在进行中。
2.爱必妥(erbitux)(IMC-C225,cetuximab) 爱必妥是一种免疫球蛋白IgG1人源化嵌合抗表皮生长因子受体(EGFR)的单克隆抗体,可以高效结合于EGFR的细胞外段,有效阻断配体与EGFR的结合,抑制受体磷酸化。而在生物体内IMC-C225抗肿瘤的机制为:①调节细胞周期,导致细胞停留在G1期;②通过下调血管内皮生成因子(VEGF)等相关因子抑制血管生成及转移;③通过打破凋亡促进因子Bax与凋亡抑制因子(bcl-2)基因的平衡表达从而促进细胞凋亡;④增强化疗作用;⑤增强放疗作用。研制中的抗EGFR单抗还包括ABX-EGF、ICR 62、EMD 55900、EMD 72000。
2004年2月12日,FDA批准爱必妥联合依立替康(irinotecan,CPT-11)用于经依立替康为基础化疗仍无法控制病情的转移性结、直肠癌患者,或者用于单一用药治疗对依立替康为基础化疗耐受的转移性结、直肠癌患者。其推荐给药方案为首次剂量400mg/m2,静脉滴注2h,维持量每周250mg/m2,静脉滴注1h。在一项关键性的多中心、随机、对照试验中,329名曾接受过以依立替康为基础化疗失败的结、直肠癌患者分别接受erbitux单药治疗(111名),或者爱必妥联合依立替康治疗(218名)。结果表明:单药组与联合组的有效率分别为10.8%与22.9%(P=0.007),生存期分别为6.9个月与8.6个月(P=0.48),联合给药组的毒副作用较爱必妥单药组明显,但与文献报道单药使用依立替康所见毒副作用相当。在2004年的ASCO会议上,爱必妥联合FOLFIRI方案,或者爱必妥联合FOLFOX-4方案用于一线治疗EGFR+的转移性结肠癌患者的临床试验获得了初步的结果,22名应用爱必妥+FOLFIRI的患者中,PR:46%,SD:41%;20名应用爱必妥+FOLFOX-4的患者中,PR:70%,SD:25%,Ⅲ期临床正在进行中。2005年的ASCO会议上的结果显示:42名接受爱必妥+FOLFOX-4方案一线治疗转移性结、直肠癌的患者中,CR:9%,PR:63%,SD:23%。(https://www.xing528.com)
爱必妥联合化疗药物如泰索帝、顺铂、长春瑞滨等,或者联合放疗治疗其他实体瘤,包括肺癌、头颈部肿瘤、肾细胞癌的研究也在进行中。在一项随机化Ⅱ期临床试验中,Rosell等将62例既往未接受化疗的ⅢB/Ⅳ期EGFR+的非小细胞肺癌患者分为两组,分别给予NP方案(顺铂+长春瑞滨)化疗及NP方案联合爱必妥治疗,结果显示化疗组与联合组的有效率分别为32%及59%,具有显著性差异。另一项研究中,481名既往接受过含铂类方案化疗后复发的头颈部鳞癌患者分别接受爱必妥单药、爱必妥联合顺铂或卡铂,或其他二线方案的治疗,结果显示三组的有效率分别为13%、10%与3%,中位生存期分别为5.9个月、5.6个月与3.4个月。
与其他分子靶向药物类似,寻找能够预测爱必妥疗效的标志物的研究也正在进行中。Pippas等研究了结、直肠癌中EGFR表达与爱必妥疗效间的关系,结果显示EGFR+、EGFR++与EGFR+++患者的中位生存期分别为6.6个月、6.1个月与7.9个月,它们有所差别但并无统计学差异。Mirtsching等的分析结果表明,接受爱必妥治疗的结、直肠癌中,已有1~2处转移患者与有3~4处转移患者的中位生存期分别为165d与115d(P=0.004),更有意思的是治疗后不出现皮疹的患者与出现皮疹的患者的中位生存期分别为46d与168d(P<0.000 1),具有显著差异。
爱必妥无论单用还是与放、化疗联合应用都耐受良好,不良反应轻微且易于控制,常见的有皮疹(30%)、麻木(18%)、发热(16%)、恶心(16%),过敏反应也较常见,多发生在首次用药时,使用抗组胺药或缓慢注射均可缓解。
3.panitumumab 是完全人源化的EGFR的单克隆抗体,最新的一项Ⅲ期临床试验的结果表明在既往治疗失败的晚期大肠癌患者中,该药物单药治疗后肿瘤有所缩小的患者比例达46%,其中达到部分缓解的有8%,90%的患者都出现了皮疹。
4.格列卫(glivec)(glivec,imatinib mesylate,STI-571) 格列卫是针对bcr-abl融合基因,由人工合成的酪氨酸激酶抑制剂,可选择性抑制bcr-abl、c-kit和血小板源性生长因子受体(PDGFR)等酪氨酸激酶或底物蛋白的酪氨酸磷酸化而使其灭活,最早在慢性粒细胞白血病中应用得到显著疗效;其中c-kit激酶是干细胞因子(SCF)受体,在70%的小细胞肺癌和胃肠道间质瘤(gastrointestinal stromal tumor,GIST)患者体内表达,血小板源性生长因子及其酪氨酸激酶受体可在包括乳腺癌、胰腺癌等多种实体瘤中表达,且已有文献报道格列卫对这些肿瘤均具有一定抑制作用。此外,格列卫还可选择性抑制bcr-abl阳性细胞生长并诱导bcr-abl阳性细胞凋亡和分化;与干扰素联合用药具协同效应,与柔红霉素、阿糖胞苷、长春新碱、高三尖杉酯碱、依托泊苷及多柔比星联用则出现累加作用,但与米托蒽醌联用时则产生拮抗效应。
GIST是胃肠道最常见的间质细胞肿瘤,恶性的胃肠道间质肿瘤对化疗不敏感,且对放疗抵抗,手术是其唯一的治疗手段,但是对于转移性肿瘤效果也不佳。格列卫作为kit酪氨酸激酶抑制剂可以抑制kit激酶进而阻止肿瘤发展,最终可能控制GIST。一项Ⅱ期研究中147名进展期GIST患者接受格列卫400~600mg/d治疗,总有效率53.7%,均为PR,另有27.9%病情稳定,中位有效时间>24周。另一项EORTC的Ⅲ期临床试验中,298名GIST患者接受格列卫400mg/d治疗,317名GIST患者接受格列卫800mg/d治疗,结果两组的有效率分别为50.3%及51.1%,12个月无瘤进展生存率分别为67%及74%。Bauer等使用格列卫治疗了90例转移性GIST患者,其中12例经治疗后重新获得了手术切除的机会。最近,还有学者的研究证实,经格列卫治疗后的GIST患者血液中KIT及VEGF水平明显下降,而KIT配体(stem cell factor,SCF)则明显上升;经PET、CT、MRI复查后可见大多数肿瘤明显缩小。
综合各项试验,大多数患者的不良反应,表现为水肿(71%~87%)、恶心(50%~59%)、疲劳(30%~77%)、腹泻(39%~55%)、皮疹(24%~45%)和贫血(12%~80%),但均为轻至中度,高剂量(800mg/d)或年龄>65岁患者常发生不同程度体液潴留,加速期及急变期患者可出现血小板减少症或中性粒细胞减少症。严重的不良反应要停药或减药。
5.法尼基转移酶抑制剂(zarnestra)(R115777,tipifarnib) 大约30%的人类肿瘤与ras基因突变有关,包括90%的胰腺癌,50%的结肠癌,40%的肺癌及膀胱癌。RAS蛋白定位于细胞膜内侧,接受来自细胞外生长因子、细胞因子及激素等的信号,在细胞内信号转导中发挥着重要作用,其作用类似于开关,切换于非活性的GDP结合型与活性的GTP结合型,活化的RAS-GTP蛋白可促进细胞增殖。RAS蛋白需要经过一系列的加工修饰才能定位于细胞膜内侧,其中法尼基化是第一步也是其中最重要的一步,法尼基转移酶抑制剂(farnesyl transferase inhibitors,FTI)干扰RAS蛋白的法尼基化修饰,可使ras基因激活的肿瘤生长受到抑制,且对正常细胞无明显毒性。目前已进入临床试验的FTI有R115777(zarnestra)、SCH-66336(sarasar)、BMS-214662、L-778,123。
R115777是一种可口服的FTI,能够特异性阻断生长因子依赖性的细胞信号转导途径蛋白的法尼基化。已进行的临床试验的适应证包括急性白血病、结肠癌、前列腺癌、非小细胞肺癌、胰腺癌等。多项Ⅰ期临床结果显示剂量300mg每日2次可达有效浓度,1 200mg每日2次时可见明显中枢神经毒性(包括共济失调及失语),其他不良反应还包括恶心、疲劳、骨髓抑制及感觉异常。一项Ⅱ期临床试验比较了R115777两种给药方案:300mg或400mg每日2次,连续给药(CD)及300mg每日2次,给药21d间隔7d(ID),对76名进展期乳腺癌患者疗效及不良作用,结果显示CD组PR及SD分别为10%及15%,ID组为14%及9%;CD组及ID组出现中性粒细胞减少症分别为43%及14%,血小板减少症26%及3%,神经毒性症37%及3%。此外还有关于使用R115777治疗胰腺腺癌等的报道。
二、血管内皮生长因子抑制剂
人体大部分肿瘤的生长和转移都依赖于病理条件下的血管生成,因此,抑制肿瘤介导的血管生成为肿瘤治疗提供了一个非细胞毒性的新途径。血管生成是一个受众多正性或负性调节因子调节的复杂生理过程,在这些调节因子中,血管内皮生长因子(vascular endothelial growth factor,VEGF)是目前已知作用最强、专属性最高的促血管生成因子。目前靶向VEGF及其受体的抑制剂很多,研究较多的是VEGF单克隆抗体及VEGF受体酪氨酸激酶抑制剂,前者如贝伐单抗(avastin),后者属于小分子抑制剂,具有口服易吸收、剂量小、可长期用药等优点,包括SU5416、SU6668、ZD4190、ZD6474、PTK787等均已进入临床试验。
贝伐单抗(bevacizumab,rhuMAb-VEGF)是第一个人源化的抗VEGF单抗,能够结合并阻断VEGF的作用,从而发挥抗肿瘤活性,已于2004年2月26日经FDA批准与标准的IFL方案(依立替康+氟尿嘧啶+四氢叶酸)联合用于转移性结肠癌的一线治疗,其推荐剂量为5mg/kg,目前的研究多倾向于使用10mg/kg,静脉注射,每2周1次,直至病情进展。
早期的Ⅰ期临床试验证实了贝伐单抗具有临床抗肿瘤活性,且无论单用或联用,细胞毒药物副作用均可耐受,因而以大肠癌为主的多项Ⅱ/Ⅲ期临床试验同时展开。2003年结束的一项随机、对照Ⅱ期临床试验中,104名未经治疗的转移性结、直肠癌患者随机接受FL方案(氟尿嘧啶+四氢叶酸)、FL+贝伐单抗5mg/kg、FL+贝伐单抗10mg/kg 3种方案中的1种治疗。结果显示三组的有效率分别为17%、40%及24%,生存期分别为13.8个月、21.5个月、13.8个月。后续的Ⅲ期临床试验则比较了IFL方案单用或联用贝伐单抗5mg/kg一线治疗813名转移性结、直肠癌患者,化疗组与联合组的有效率分别为34.8%与44.8%(P=0.004),中位生存时间分别为15.6个月与20.3个月,联合组的有效率与中位生存时间与经典的FOLFOX方案均相当(45%,19.5个月),高血压是联合组最常见的不良反应,但可控制。最近的关于生活质量影响的回顾性分析则显示,当贝伐单抗与IFL方案联合应用的时候可以显著延长生存期及无进展生存时间而不影响生存质量(QOL),而贝伐单抗与FL方案联合应用的时候,在延长无进展生存时间的同时也可明显延长生存质量恶化时间(time to deterioration in QOL,TDQ)。2005年的ASCO会议上报道了贝伐单抗联合FOLFOX-4化疗方案治疗大肠癌的Ⅲ期临床研究E3200的进一步结果,829名既往接受过含氟尿嘧啶类药物或含依立替康方案治疗后的进展期结、直肠癌患者,随机接受贝伐单抗单药(10mg/kg)、FOLFOX-4方案或者贝伐单抗联合FOLFOX-4方案治疗,结果显示3组的中位无进展生存时间分别为3.5个月、5.5个月、7.4个月,3组的中位生存期分别为10.2个月、10.7个月、12.5个月。单独应用贝伐单抗与单独应用FOLFOX-4方案并无显著差异,而联合用药组在中位无进展生存时间及中位生存期方面均较单独用药组有显著优势。
贝伐单抗与其他抗血管生成治疗或其他分子靶向药物的联合应用也已获得了一定进展。VEGF是目前已知的血管生成过程中最重要的生长因子,贝伐单抗的抗血管生成作用也已得到证实,临床前研究已经证实了贝伐单抗与小剂量、长疗程的抗血管生成化疗(metronomic chemotherapy)相联合具有协同作用。贝伐单抗联合其他分子靶向药物如tarceva、glivec、letrozole的研究也已在进行中。
血栓形成是使用贝伐单抗后最严重的不良反应,曾有患者因此致命,其他的毒副作用还包括高血压、蛋白尿、鼻出血等。
三、多靶点抑制剂
多靶点抑制剂(多吉美,sorafenib)是针对RAF激酶和VEGF-R2的小分子抑制剂,是一种多靶点作用的药物,更符合肿瘤发生过程中基因作用的机制。多吉美已经完成了在原发性肝癌和肾癌中的Ⅱ期临床研究。原发性肝癌的一项Ⅱ期临床研究中,有137例既往未曾接受过治疗的晚期肝癌患者加入,每日2次口服多吉美400mg,4周为1个疗程。两个疗程结束后进行疗效评价。其中有5.8%的患者达到了MR(minimal response),33.6%的患者达到了稳定(SD),疾病无进展时间为4.4个月,总生存期为9.2个月,无严重的毒性反应。在一项肾癌的Ⅱ期研究中,202例晚期肾癌患者纳入研究,全部患者进入12周的多吉美400mg每日2次的导入期,导入期结束时,有73例患者(36%)的肿瘤都有不同程度的缩小,以后随机分为两组,一组继续给予多吉美,另一组给予安慰剂,结果多吉美组的无瘤进展时间为24周,安慰剂组为6周。药物的主要不良反应为皮疹、手足综合征、乏力等,较为轻微,无毒性致死性死亡。
四、展望
随着靶向药物在临床的成功应用,传统的治疗也得到了提升。从临床治疗发展的进程来看,强强联合是一种趋势。如何将多种有效的药物合理地联合应用,以最大限度地增加抗肿瘤的疗效是临床亟待解决的问题。这种联合应用包括3种方式:①同类靶向药物的联合,如吉非替尼+埃罗替尼;②同一靶点,但针对不同位点的药物联合,如吉非替尼/埃罗替尼+西妥昔单抗;③不同靶点的药物联合,如针对EGFR的靶向药物(吉非替尼/埃罗替尼/西妥昔单抗)+针对另一靶点的药物,如抗血管生成药贝伐单抗,以及各种化疗药物。由于前两种联合用药存在受体饱和及竞争性结合等问题,临床上以第3种联合用药方式多见,如曲妥珠单抗+埃罗替尼治疗转移性乳腺癌,西妥昔单抗+化疗药物治疗大肠癌和乳腺癌等在Ⅱ期研究中已经显示出良好疗效。虽然目前在靶向药物的临床使用中,还有一些问题,比如小分子物质与化疗药物的联合疗效,靶向药物与放疗或化疗联合的合适时机及给药顺序进一步的探索。
但是,靶向药物长期使用的不良反应不容忽视,因为调控必然会干扰正常功能。例如利妥昔单抗抑制B细胞,长期应用必然导致B细胞功能低下甚至影响体液免疫功能;也有报道吉非替尼长期应用后出现伤口愈合困难;埃罗替尼发生迁延不愈的皮疹;曲妥珠单抗长期应用会引发心脏毒性等。因此,随着靶向药物的深入使用,还会遇到很多的问题。但是,靶向药物的临床应用,已经给肿瘤患者的疗效带来了无限希望。
(刘天舒)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




