(一)腌干鱼制品加工过程中生物胺与理化指标、微生物的相互关系研究
1. 腌干鱼加工过程中pH和盐度的变化分析
图5-56显示了带鱼在腌制加工过程中pH、盐度的变化规律。pH表示鱼肉的有效酸度,对腌干鱼制品的色泽、风味感官特性有重要影响。由图5-56可知,带鱼pH在腌制阶段呈上升趋势,由原料时的6.28上升至6.34,这主要是由于在腌制过程中鱼肉内的微生物以及酶的作用,使鱼肉中产生了一些碱性的含氮物质;pH在干燥阶段呈明显的下降趋势,由漂洗完时的6.36下降至成品时的6.26,这一方面是因为带鱼脂肪含量较高,在干燥过程中,体内的脂肪酶以及微生物作用使得脂肪不断水解成游离脂肪酸;另一方面,刘法佳等指出乳酸菌为腌干鱼中主要菌种之一,在腌干鱼的干制过程中,适宜的温度促进了乳酸菌的产酸作用,从而进一步降低了鱼肉中的pH。带鱼中的盐度在整个加工过程中除浸泡脱盐阶段略有下降外,其余阶段均不断上升,并在成品时盐度达到7.88%。在腌制阶段由于食盐的渗透作用导致了盐度的上升;在浸泡脱盐阶段,由于鱼体表面的盐分洗脱干净而使得鱼肉的盐度略有下降;在干燥阶段,由于水分的流失,盐度进一步的增加。
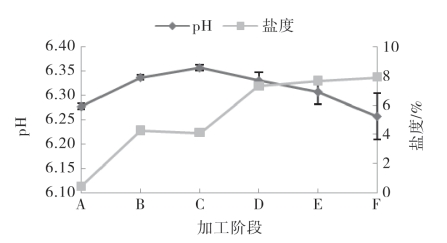
图5-56 带鱼腌干过程中的pH和盐度变化

图5-57 金线鱼腌干过程中的pH和盐度的变化
图5-57显示了金线鱼在腌制加工过程中pH、盐度的变化规律。pH在整个腌干过程中不断下降,由原料时的6.94下降到成品时的6.38,其中在腌制第1天 pH下降幅度最为明显,而pH在腌制阶段不断下降可能是由于鱼体内糖酵解反应的进行,乳酸产生而使pH逐渐下降;干制阶段pH不断下降与鱼体产生脂肪酸以及嗜盐性的微生物产酸有关。金线鱼的盐度在腌干过程中的变化趋势与带鱼一致,最终成品的盐度为17.56%,这是鱼体较小易于吸收食盐以及腌制两天的缘故。
2.腌干鱼加工过程中水分含量和Aw的变化分析
由图5-58可知,水分含量和Aw总体呈下降趋势,并呈明显的正相关性(p<0.05)。在腌制阶段,由于食盐的渗透作用,导致了鱼体内的水分渗出而略有降低,干燥过程中,水分含量一直呈明显的下降趋势,并在成品时处于50%以下。Aw在腌制阶段略有下降,这与食盐的渗透作用有关;在浸泡脱盐阶段又略有上升,这可能与部分食盐洗去以及温度有关;而在干燥时,Aw呈明显下降趋势,干燥24h后为0.86,下降最大,变化差异最为显著(p<0.05),而后继续下降,直至Aw为0.82。从微生物和Aw的关系可以看出,此Aw值下可以抑制大多数的细菌和霉菌;从酶促反应与Aw的关系可以看出,此Aw下可以使得鱼体内的一些酶活性下降,因此,腌干鱼制品在常温下可以有一个较长的贮藏期。此外有研究指出,当盐度低于7.5%时,Aw与盐度呈显著负相关,本实验研究与其相符。
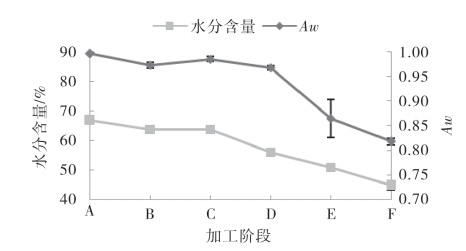
图5-58 带鱼腌干过程中的水分含量和Aw的变化

图5-59 金线鱼腌干过程中的水分含量和Aw的变化
由图5-59可知,在腌制阶段,金线鱼中的水分含量呈下降趋势,并且第1d下降明显,这可能是与盐分的渗入有关;在干燥阶段,水分含量不断下降,直至成品时的47.42。Aw除浸泡脱盐阶段由于部分盐分洗去而略有上升外,腌制和干燥阶段均呈下降趋势,干燥24h后为0.76,下降最大,变化差异最为显著(p<0.05),而后继续下降,直至Aw为0.74。在此Aw下可抑制多数嗜盐细菌以及干制霉菌,并能使酶促反应大大降低,达到长期保存的效果。
3.腌干鱼加工过程中非蛋白氮(NPN)和蛋白水解指数(P.I.)的变化分析
非蛋白氮(NPN)含量是指除了蛋白质以外的所有多肽、短肽及游离氨基酸的总含量,它是表征蛋白质降解的一个指标。
图5-60和图5-61显示了腌干带鱼和金线鱼加工中非蛋白氮以及蛋白水解指数的变化情况。
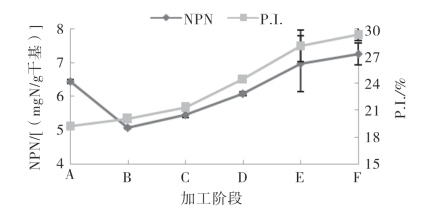
图5-60 带鱼腌干过程中的非蛋白氮和蛋白水解指数的变化
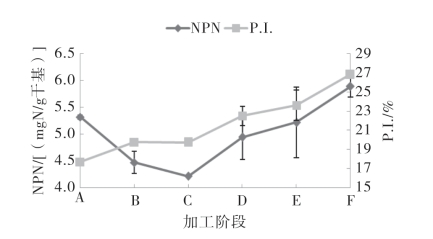
图5-61 金线鱼腌干过程中的非蛋白氮和蛋白水解指数的变化
从图中可看出,在腌制过程中,带鱼中非蛋白氮的含量下降至5.98mgN/g。金线鱼中非蛋白氮的含量也是不断下降的,由原料时的5.32mgN/g下降至4.21mgN/g。这是由于食盐的渗入造成鱼肉细胞内外渗透压差异,导致鱼肉体液大量析出,鱼肉中的非蛋白氮带入了腌制液中,当腌制结束后,随着腌制液大量流失;另一方面,可能是被鱼体内的微生物部分利用所致。腌制后,两种鱼中非蛋白氮含量均随着加工的进行逐渐升高,这主要是由于在干制过程中,鱼体内的蛋白质在组织蛋白酶、氨肽酶等内源酶的作用下发生了不同程度的水解。同时蛋白质水解受到干制工艺、干燥温度、盐度、Aw以及酶活性等多方面的影响,其中,酶活性对蛋白质水解影响较大。有研究表明组织蛋白酶在35℃范围内显示较好的酶活特性,大部分氨肽酶的最适温度为20~35℃,实验中采用的25℃晾晒以及30℃冷风干燥,温度恰好接近于水解蛋白质酶的最适温度,从而导致了非蛋白氮在干燥阶段的不断上升。
鱼体腌制过程中,蛋白质水解程度的宏观进程可以用蛋白水解指数(P.I.)表示。在整个加工过程中带鱼的蛋白水解指数值由原料时19.19%上升到成品时的29.41%,呈明显上升趋势;金线鱼的蛋白水解指数值由原料时的17.68%上升到成品时的26.80%。在腌制阶段,由于盐分向肌肉内部渗透,破坏肌肉蛋白质的结构,蛋白酶更易作用蛋白质,使其降解程度增大,带鱼和金线鱼在腌制结束后蛋白水解指数值分别较原料增加了3.97%和11.59%;浸泡脱盐后,蛋白水解指数值均显著上升(p<0.05),干燥结束后,带鱼和金线鱼蛋白水解指数值相比原料分别升高了34.74%和51.61%。
4.腌干鱼加工过程中游离氨基酸的变化分析
腌干鱼加工过程中游离氨基酸的变化分析结果如表5-23所示。
表5-23 带鱼腌干过程中主要游离氨基酸含量变化 (g/100g) 单位:g/100g

注:同行数据的不同字母表示差异显著(p<0.05)。
由表5-23可见,在腌制阶段,带鱼除脯氨酸、异亮氨酸、亮氨酸、赖氨酸外,主要游离氨基酸均有不同程度的上升,其中,组氨酸的变化幅度最大,增加了4倍多;苯丙氨酸、酪氨酸、丝氨酸和甘氨酸含量也上升了17.95%~75.00%,其他氨基酸含量变化不大。这可以看出在氨肽酶等酶的作用下鱼肉中的蛋白质、小肽等降解留在鱼体内的游离氨基酸要明显高于流入腌制液内的游离氨基酸。在浸泡脱盐阶段,除了异亮氨酸保持不变外,其余15种游离氨基酸的含量均发生了不同程度的下降,其中组氨酸、甘氨酸较腌制阶段分别下降了75.00%、42.86%,下降最为明显。这可能是由于漂洗的作用,使得鱼肉中部分游离氨基酸随流水而流失。在晾晒6h过程中,除甘氨酸、赖氨酸和组氨酸外,其余游离氨基酸的含量均继续下降,其中酪氨酸、异亮氨酸下降较为明显,分别下降了40.00%和30.00%。这可能是由于游离氨基酸脱羧、脱氨产生了部分的胺类或进一步反应生成醛、酮以及含硫化合物等挥发性风味物质。从干燥开始到成品的过程中,16种游离氨基酸的含量均有明显的上升(p<0.05)。主要原因是,在干燥过程中蛋白质逐渐分解,表现为蛋白质水解指数不断增加,具体表现为该温度下活性较高的氨肽酶等将肌浆蛋白、肌原纤维蛋白等蛋白逐渐分解,从而出现氨基酸等小分子物质的累积;在干燥后期,赖氨酸的含量发生了下降,可能原因是其参与了风味物质的形成。与原料相比,干制后的咸带鱼中大多数游离氨基酸含量都提高了2~3倍,可见干燥阶段是腌干鱼产生特殊风味的阶段,其中,谷氨酸、丙氨酸、亮氨酸和赖氨酸是咸带鱼中主要的游离氨基酸,含量分别占总游离氨基酸量的9.75%、13.50%、11.13%和12.00%。总游离氨基酸含量在整个加工过程中呈现先上升后下降再上升的趋势,这一变化趋势与非蛋白氮的变化趋势不符。此外,在整个加工过程中精氨酸的含量始终处于较低的水平,这可能由于其具有与还原性化合物进行强烈美拉德反应的特点。
表5-24显示了腌干金线鱼加工过程中游离氨基酸含量的变化。
表5-24 金线鱼腌干过程中主要游离氨基酸含量变化 单位:g/100g

由表可知,在腌制第1d,除脯氨酸、甘氨酸、丙氨酸、赖氨酸外,其他氨基酸含量均发生了不同程度的上升,其中,天冬氨酸、酪氨酸、苯丙氨酸增加了2倍多,赖氨酸下降幅度最大,由0.0840g/100g下降到腌制第1d结束时的0.0080g/100g,这可能是赖氨酸腌制过程中流入到腌制液的缘故。腌制第2d结束后,除谷氨酸、丙氨酸、甘氨酸和精氨酸未上升外,其余13种氨基酸以及总游离氨基酸含量均发生了不同程度的上升,因此,腌制2d过程中,鱼体内的蛋白质或者多肽小肽等再一次被组织性酶等分解成游离氨基酸,同时,此阶段鱼体的风味也发生了变化。浸泡脱盐后,大部分游离氨基酸含量有不同程度的下降,这可能是由于在洗脱过程中,清水带走了鱼体表面的一些游离氨基酸。从干燥开始到成品过程中,16种游离氨基酸的含量均发生了明显的上升(p<0.05),其原因与带鱼的一致。与原料相比,干制后的腌干带鱼中大多数游离氨基酸含量都提高了2~3倍,可见干燥阶段是腌干鱼产生特殊风味的阶段,其中,谷氨酸、甘氨酸、缬氨酸、苯丙氨酸四种游离氨基酸是腌干金线鱼最主要的游离氨基酸,分别占总游离氨基酸的9.51%、11.80%、7.87%和22.13%。
5.腌干鱼加工过程中微生物的变化分析
带鱼腌干过程中主要微生物变化如图5-62所示。乳酸菌、葡萄球菌和微球菌作为腌干鱼中主要的微生物,菌落总数在腌干鱼整个加工过程总体呈上升趋势。其中,在腌制期间,均有缓慢的增加,这可能是由于温度始终处于4℃,且食盐的影响使得微生物生长缓慢。在晾晒6h过程中,微生物均有明显的增加(p<0.05),因为这个阶段,适宜的温度、足够的水分促进了它们的快速生长。在冷风干制过程中,菌落总数基本无变化,乳酸菌在干燥后期开始下降,而葡萄球菌、微球菌不断上升。分析其原因,我们认为腌干鱼类干燥过程中理化特性的变化影响了菌相的变化,在这个阶段,虽然温度适宜它们的生长,但同时鱼体内的盐度不断增加,且Aw不断降低,这样的条件,抑制了细菌、乳酸菌的生长,而对耐盐性的葡萄球菌和微球菌则影响不大。
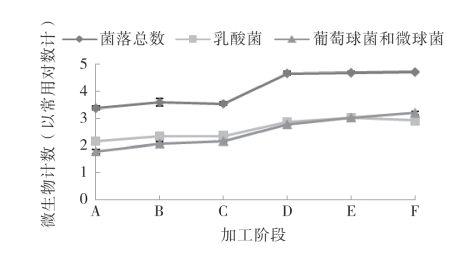
图5-62 带鱼腌干过程中的主要微生物变化
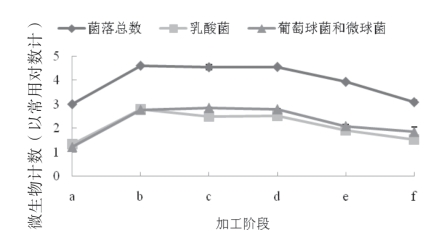
图5-63 金线鱼腌干过程中的主要微生物变化
图5-63显示了金线鱼腌干过程中主要微生物的变化。在腌制第1d,四种微生物均发生显著的上升,而在腌制第2d,菌落总数、葡萄球和微球菌基本无增长,乳酸菌则发生了下降,这可能是腌制温度以及盐度增加的原因。在干燥阶段,微生物均呈下降趋势,这可能是由于在干燥阶段Aw在0.8以下,以及盐度较高(>15%)导致了菌落生长受到抑制甚至死亡。
6.腌干鱼加工过程中生物胺及其相关性生物胺指标的变化分析
由表5-25和表5-26可知,与原料相比,带鱼和金线鱼成品的总生物胺量含量分别增加了2.26和1.06倍,带鱼由腌制时的(26.98±1.24)mg/kg上升到脱盐后的(44.95±0.63)mg/kg,金线鱼则由腌制时的(26.98±1.24)mg/kg上升至脱盐后的(35.00±0.47)mg/kg;带鱼在晾晒6h后含量下降至(44.95±0.63)mg/kg,冷风干燥阶段含量则继续上升,总生物胺在原料中含量最低,在成品时含量达到最大,总体变化趋势与总游离氨基酸一致,而金线鱼在冷风阶段总生物胺量不断上升。除带鱼原料中未检测出色胺外,8种生物胺均存在于带鱼和金线鱼腌干加工的各个阶段;同时,除亚精胺、精胺外,其余6种生物胺及总生物胺在加工过程中均发生了不同程度的改变。带鱼成品中的色胺含量较腌制后增加3.5倍,2-苯乙胺、腐胺和酪胺随着加工的进行,含量不断的增加,但色胺、2-苯乙胺、腐胺、酪胺在整个过程中的含量均处于较低的值(均低于3.2mg/kg),这一现象在金线鱼中同样存在。这可能与它们的前体物质含量较少有关。亚精胺和精胺在肉制品中自然存在,是鱼肉的组成性胺类,由表5-25和表5-26可以看出,两者的含量始终处于一个稳定且较低的值(均低于1.5mg/kg)。带鱼中尸胺在腌制加工过程含量显著增加(p<0.05),从原料时的(0.40±0.01)mg/kg增加到成品时的(63.55±0.00)mg/kg,增长了157倍;金线鱼则由原料时的(1.20±0.05)mg/kg上升到成品时的(17.07±0.01)mg/kg,增长了13倍。由此可见,尸胺是腌干鱼冷风干燥阶段的主要胺类物质;组胺是带鱼和金线鱼腌干整个过程中主要的胺类物质,其所占总生物胺的比例范围分别为15.22%~82.76%和46.72%~74.36%,整个加工过程中两种腌干鱼中组胺的含量均远低于国家规定限量(300mg/kg),也低于美国食品药品监督管理局规定(50mg/kg)。
当酪胺摄入量在100~800mg/kg时,人体会产生过敏反应,而本实验中的酪胺含量远低于100mg/kg。Nout指出2-苯乙胺的含量超过30mg/kg也会对人体造成潜在危害,显然本实验中的2-苯乙胺含量远低于限量值;此外,Santos认为食品中总生物胺含量不超过1000mg/kg,本实验的结果也远低于1000mg/kg,因此,对于腌干鱼来说,得当的操作以及较好的卫生条件,可以保证产品的质量。
图5-64和图5-65显示了单胺、二胺和多胺在带鱼和金线鱼加工过程中的变化情况。单胺是两种腌干鱼加工过程中最主要的胺类。带鱼和金线鱼中二胺在冷风干燥阶段为最主要的胺类,其含量在冷风干燥前处于较低的水平,冷风干燥后急剧增加,并在成品时分别达到最大值(66.69±0.05)mg/kg和(21.47±0.02)mg/kg,比原料分别增加了约60倍和9倍。多胺作为鱼肉基本组成部分,在整个加工过程中始终处于一个较低且稳定的含量(均低于2.5mg/kg)。
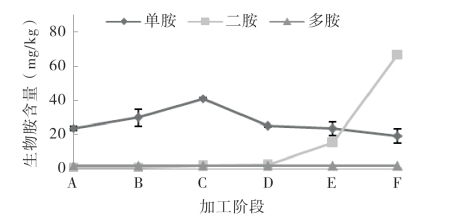
图5-64 带鱼腌干过程中的单胺、二胺和多胺的变化

图5-65 金线鱼腌干过程中的单胺、二胺和多胺的变化
图5-66和图5-67显示了生物胺指数(BAI)和质量指数(QI)在加工过程中的变化情况,两种鱼中生物胺指数和质量指数在腌干过程中总体呈上升趋势,并且生物胺指数、质量指数与总生物胺量的变化趋势相似,这一结果与钟赛意等的研究一致。同时,由于尸胺、组胺和酪胺是主要生物胺,因此涵盖其三者的生物胺指数与总生物胺含量非常相近,生物胺指数在一定程度上可以替代总生物胺含量。
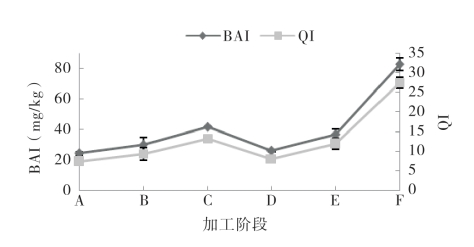
图5-66 带鱼腌干过程中的生物胺指数和质量指数的变化

图5-67 金线鱼腌干过程中的生物胺指数和质量指数的变化
7.生物胺与理化、微生物指标相关性分析
有报道指出,某些特定的菌株为了克服或者减少温度、NaCl以及其他生物、化学、物理因素影响所引起细胞的应激反应,产生了相应的某些生物胺。低pH的环境可以提高细菌产生物胺的能力,但同时也会抑制其他微生物的活性,因此两方面相互作用,决定生物胺生成量,由表5-27和表5-28可以看出,带鱼的pH与组胺、单胺呈明显的正相关(p<0.05),可能是产组胺菌在弱酸下活性较强,而金线鱼的pH与腐胺、尸胺和二胺呈明显的正相关(p<0.05),与酪胺、总生物胺量和生物胺指数相关性极显著(p<0.01),可见金线鱼的pH显著影响生物胺的生成。NaCl影响生物胺的形成是因为高浓度的NaCl会使发酵体系形成高渗透压,抑制微生物的生长,但同时一些耐高盐的菌种的脱羧酶的活性会增强,带鱼的盐度与2-苯乙胺显著正相关(p<0.05),与酪胺、亚精胺正相关性极显著,同时与精胺、多胺负相关性极显著(p<0.01)。可以看出,在高盐环境中,带鱼中的2-苯乙胺、酪胺的形成与耐盐菌种有关,而金线鱼的盐度与酪胺、总生物胺量、生物胺指数和质量指数显著正相关(p<0.01),可见盐度也显著影响金线鱼中生物胺的生成。水分含量以及Aw的降低可以抑制微生物的生长,本实验中,它们与带鱼中的色胺、2-苯乙胺、腐胺、尸胺等呈显著的负相关性(p<0.05),而与主要胺类组胺的正相关性不显著(p>0.05);但金线鱼中的水分含量与总生物胺量、生物胺指数、二胺等负相关性极显著(p<0.01),可见金线鱼的水分含量和Aw均影响生物胺的生成。综上所述,带鱼腌制加工过程生物胺的形成受多种环境因素的共同影响,变化各有不同,而金线鱼中生物胺的生成极易受环境因素的影响,变化显著。
富含蛋白质的肉制品在蛋白酶、肽酶的作用下形成各种多肽、小肽,进而在氨肽酶等作用下形成各类游离氨基酸。游离氨基酸是生物胺形成的前体物质,精氨酸可通过精氨酸亚胺酶脱羧途径形成鸟氨酸,再脱羧形成腐胺,同时也可以直接脱羧产生精胺和亚精胺,赖氨酸、组氨酸、苯丙氨酸和酪氨酸分别在酶作用下脱羧形成尸胺、组胺、2-苯乙胺和酪胺。由表5-27和表5-28可知,带鱼中苯丙氨酸、赖氨酸、组氨酸、酪氨酸和精氨酸与其对应的生物胺均没有明显的相关性(p>0.05),而总游离氨基酸与腐胺、尸胺、总生物胺、生物胺指数以及质量指数呈极其显著的正相关(p<0.01);金线鱼中酪氨酸与酪胺呈极显著正相关(p<0.01),总游离氨基酸与总生物胺量呈明显正相关性(p<0.05),表明游离氨基酸作为前体物质对生物胺的形成影响较大。同时,带鱼的非蛋白氮与组胺呈显著负相关,蛋白水解指数值与色胺呈显著正相关(p<0.05),与精胺、多胺显著负相关(p<0.05),与2-苯乙胺以及酪胺正相关性极显著(p<0.01);金线鱼的非蛋白氮与多胺呈显著负相关(p<0.05),蛋白水解指数值与酪胺、总生物胺量等相关极显著(p<0.01),可见金线鱼的蛋白质水解程度显著影响生物胺的生成。
具有氨基酸脱羧酶的微生物是生物胺的制造者。相关报道表明,乳酸菌、葡萄球菌和微球菌均有产生物胺的能力,但也可起到降解的作用。由表5-27和表5-28可知,带鱼中乳酸菌、葡萄球菌和微球菌与2-苯乙胺、酪胺、亚精胺正相关性显著,与精胺、多胺负相关性显著(p<0.05);同时,菌落总数与酪胺正相关,与精胺负相关性显著(p<0.05),表明咸带鱼中的乳酸菌、葡萄球菌、微球菌以及细菌对某些生物胺的生成有促进或者抑制的作用。金线鱼中菌落总数与酪胺、亚精胺显著正相关(p<0.05),与精胺显著负相关(p<0.05),乳酸菌、葡萄球菌与微球菌与生物胺则无明显相关性(p>0.05),表明金线鱼中的微生物与生物胺的形成关系不明显。
表5-25 带鱼腌干过程中8种生物胺和总生物胺含量的变化 单位:mg/kg

续上表

注:同列数据的不同字母表示差异显著(p<0.05);ND表示未发现。
表5-26 金线鱼腌干过程中8种生物胺和总生物胺含量的变化 单位:mg/kg
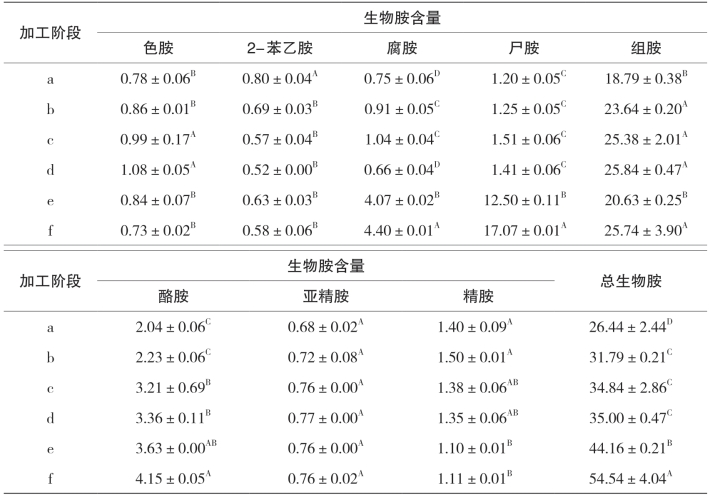
注:同列数据的不同字母表示差异显著(p<0.05); ND表示未发现。
表5-27 生物胺与理化、微生物指标之间的Pearson相关系数(带鱼) 单位:mg/kg

注:**在0.01 水平(双侧)上显著相关,*在0.05 水平(双侧)上显著相关。
表5-28 生物胺与理化、微生物指标之间的Pearson相关系数(金线鱼) 单位:mg/kg

注:**在0.01 水平(双侧)上显著相关,*在0.05 水平(双侧)上显著相关。
(二)腌干鱼制品腌制和干燥过程8种生物胺的变化研究
1.不同食盐添加量对腌干鱼生物胺及总生物胺量的影响
不同食盐添加量对腌干鱼中8种生物胺及总生物胺量的影响见表5-29和表5-30。两种鲜鱼中组胺均为主要胺类物质并远低于国家标准300mg/kg,其他7种生物胺含量均处于较低的水平(低于2.5mg/kg)。就带鱼而言,除第1d尸胺、组胺和酪胺,添加8%、17%和25%食盐的带鱼与未添加食盐的带鱼相比,8种生物胺在腌制4d过程中均得到明显抑制(p<0.05);对金线鱼而言,除第1d组胺外,食盐的添加对金线鱼中生物胺有显著影响(p<0.05),腌制过程中,添加8%、15%、25%食盐的金线鱼与未添加食盐的金线鱼比较,体内的生物胺生成得到明显的抑制。对于未添加食盐的带鱼和金线鱼而言,在15℃贮藏过程中,体内8种生物胺的含量明显上升。带鱼中生物胺中主要胺类腐胺、尸胺、组胺和酪胺分别从0.63mg/kg上升到24.83mg/kg、0.40mg/kg上升到188.938mg/kg、21.32mg/kg上升到100.83mg/kg、2.31mg/kg上升到38.28mg/kg;金线鱼中腐胺、尸胺、组胺和酪胺分别从0.76mg/kg上升到84.34mg/kg、0.77mg/kg上升到209.44mg/kg、19.03mg/kg上升到137.07mg/kg、2.13mg/kg上升到27.35mg/kg,上升速率明显高于添加食盐的鱼。食盐添加量为8%、15%、25%的带鱼和金线鱼,在4天的腌制过程中,色胺、2-苯乙胺、腐胺、酪胺、亚精胺、精胺无显著差异(p>0.05),含量均较低、较接近,说明食盐的添加抑制了产胺菌的生长以及各种氨基酸脱羧酶的活性;但在腌制同一阶段,带鱼和金线鱼中组胺却随着食盐添加量越大含量越低,带鱼中的酪胺也有此现象,这可能是由于随着食盐质量分数的增大,渗透压也随着增加,加快了渗透过程,使食盐内渗量随着增加,进而导致鱼体内产组胺菌脱水明显,降低了其生物活性。NaCl可破坏位于细菌细胞膜上的氨基酸脱羧酶来降低食品中生物胺的积累。
表5-29 不同食盐添加量对带鱼中8种生物胺的影响 单位:mg/kg
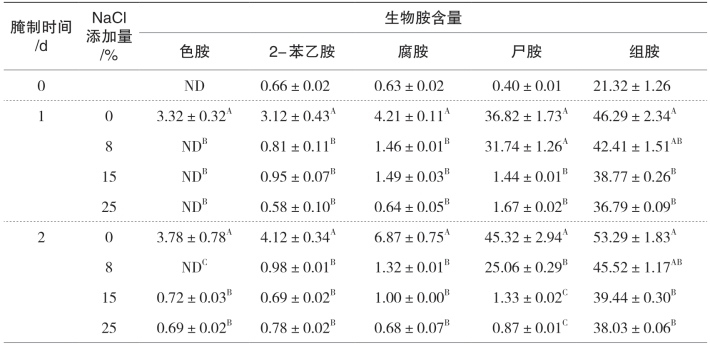
续上表

注:ND代表未检出;同列不同字母表示同一天不同食盐添加量间具有显著差异,p<0.05。
表5-30 不同食盐添加量对金线鱼中8种生物胺的影响 单位:mg/kg

续上表
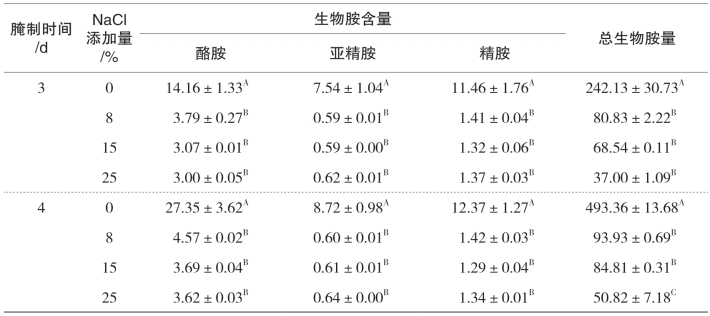 (https://www.xing528.com)
(https://www.xing528.com)
注:ND代表未检出;同列数据不同字母表示同一天不同食盐添加量间具有显著差异,p<0.05。
2.不同腌制温度对腌干鱼8种生物胺及总生物胺量的影响
由表5-31和表5-32可知,腌制温度对两种鱼中的8种生物胺和总生物胺量均有不同程度的影响,精胺、亚精胺、色胺以及2-苯乙胺在腌制过程中,含量均较低,腌制温度对它们的影响不大。对于酪胺,带鱼在腌制过程中,腌制温度越高则其含量越高(p<0.05);金线鱼在腌制前两天,腌制温度对其影响较小,腌制后两天,腌制温度越高,其含量也是越大(p<0.05)。在腌制的过程中,腌制温度对腐胺、尸胺以及组胺等主要生物胺有极显著的影响,随着腌制温度的升高,两种鱼在同一天各自的含量均发生明显的增加。研究表明随着腌制温度的升高,渗入鱼肉内的食盐含量也会随之增加,可以推断鱼体内产生物胺的菌类因食盐浓度增大发生脱水等现象造成活性降低,进而使得生物胺的含量下降。然而本研究的结果却与之相反。因此可以推测,腌制温度上升导致产生物胺菌活性增强的因素要大于前者。温度的升高一方面可以促进微生物的生长和蛋白质的分解,另一方面也会提高蛋白水解酶和氨基酸脱羧酶的活性,加速生物胺的合成。但生物胺的形成和环境温度之间并不是简单的正相关或者负相关,而是一个极其复杂的关系,比如含盐量的不同、温度的不同以及腌制过程中大量的非蛋白氮流入腌制液中都会改变腌制液的pH等理化性质。因此,仍需进行后续的实验去探明生物胺与温度的关系。
本实验可以预见,温度对生物胺形成影响很大,低温腌制相对可获得较好的鱼肉品质。
表5-31 不同腌制温度对带鱼中8种生物胺和总生物胺量的影响 单位:mg/kg

注:ND代表未检出;同列数据不同字母表示同一天不同食盐添加量间具有显著差异,p<0.05。
表5-32 不同腌制温度对金线鱼中8种生物胺和总生物胺量的影响 单位:mg/kg
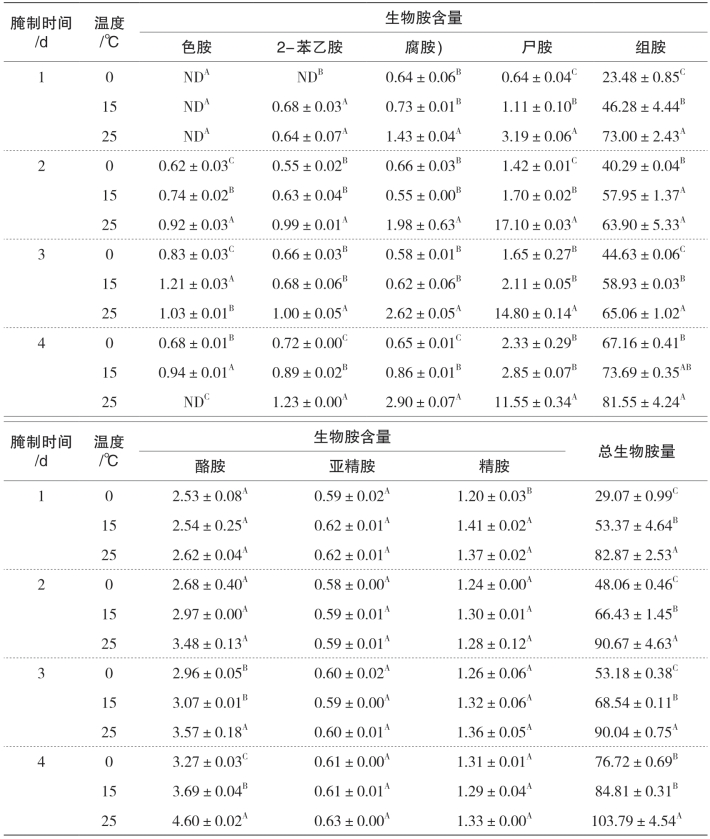
注:ND代表未检出;同列数据不同字母表示同一天不同食盐添加量间具有显著差异,p<0.05。
3.不同腌制时间对腌干鱼8种生物胺及总生物胺量的影响
由图5-68和图5-69可知,两种鱼中总生物胺量和组胺含量随着腌制时间的增加而逐渐增加(p<0.05)且变化趋势相似,由此可见组胺为腌干鱼制品腌制过程中的优势生物胺。带鱼腌制4d比腌制1d的总生物胺量和组胺含量分别增加了24.75%和30.11%,金线鱼腌制4d比腌制1d的总生物胺量和组胺含量分别增加了58.9%和59.2%。两种鱼中,尸胺、酪胺随着腌制时间的增长略有上升,而2-苯乙胺、亚精胺和精胺随着腌制时间的增长基本无变化。

图5-68 不同腌制时间对带鱼中8种生物胺和总生物胺量的影响
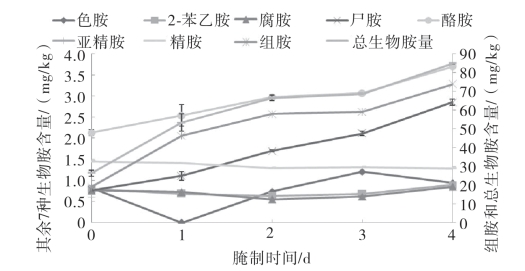
图5-69 不同腌制时间对金线鱼中8种生物胺和总生物胺量的影响
4.干燥工艺对腌干鱼中8种生物胺及总生物胺量的影响
由表5-33和表5-34可知,干燥方式显著影响腌干鱼制品生物胺含量变化,其中日晒方式带鱼和金线鱼的总生物胺量为分别为81.87mg/kg和430.13mg/kg。日晒条件下,金线鱼中尸胺、组胺、腐胺、2-苯乙胺、亚精胺含量均明显升高,其中尸胺和组胺是最主要的胺类物质,占了总生物胺含量的97.75%;带鱼中色胺、腐胺、尸胺和组胺均明显上升,其中尸胺和组胺占了总生物含量胺的91.33%。这可能是由于腌干鱼在日晒过程始终处于露天环境中,适宜的温度以及大气条件使得产生物胺菌生长活跃。冷风干燥条件下,10℃下金线鱼中尸胺的含量(360.80mg/kg)明显高于20℃时的(9.90mg/kg)和30℃时的(20.51mg/kg)(p<0.05),这一现象在带鱼中也同样存在。可以看出在10 ℃由于干制时间的延长使主要胺类尸胺的含量增加。20℃干燥的带鱼和金线鱼中组胺的含量要明显高于其他两个温度(p<0.05),而30℃干燥的产品中8种生物胺含量均处于较低的水平。热风干燥条件下,40℃干燥的金线鱼产品中未检出色胺,组胺的含量明显低于50℃和60℃干燥的产品(p<0.05),但尸胺的含量为61.86mg/kg,明显高于其他两组,且比冷风30℃干燥产品高;而热风干燥下的带鱼产品各生物胺含量均处于较低的水平。真空干燥条件下,50℃干燥的金线鱼产品中组胺的含量要明显高于60℃(p<0.05),而60℃真空干燥产品中尸胺的含量要明显高于50℃,这一现象在带鱼中也同样存在,可以看出产生物胺菌在缺氧条件下仍可生存。
不同种类干燥方式下,金线鱼中的2-苯乙胺、酪胺、亚精胺、尸胺、腐胺在60℃真空干燥的含量明显高于其他干燥方式(p<0.05),带鱼中腐胺的含量在60℃真空干燥明显高于其他干燥方式(p<0.05);50℃热风干燥的金线鱼产品中组胺含量明显高于其他干燥方式(p<0.05),可以看出高温度并不适合腌制鱼的干制,在干制前期鱼肉温度不断升高是生物胺急剧积累的过程。金线鱼中尸胺含量在所有干燥方式下均处于较高的水平,且在60℃真空干燥、日晒和10℃冷风干燥样品中的含量均超过350mg/kg,40℃热风干燥,含量达到61.86mg/kg;带鱼中的尸胺含量在10℃冷风干燥条件下最高,其次是在60℃真空干燥;组胺为腌干金线鱼制品中另一个主要胺类物质,该实验中组胺的含量除在20℃冷风干燥和60℃热风干燥外,均发生了显著的下降(p<0.05),且在60℃真空干燥下达到最低;而带鱼中的组胺除日晒以外均发生了不同程度的下降。在日晒条件下,带鱼和金线鱼的总胺量达到最大值,可见干制条件的不同显著影响鱼体中生物胺的形成。
综上所述,同一类型干燥条件,干燥温度的不同以及干燥类型的不同都显著影响着腌干鱼中主要生物胺及总生物胺量。冷风干燥较热风干燥有利于抑制腌干鱼生物胺的产生,30℃冷风干燥条件下,两种产品的总生物胺量均最低,最能保证产品的品质和安全性。
表5-33 不同干燥条件对腌干带鱼中8种生物胺的影响 单位:mg/kg
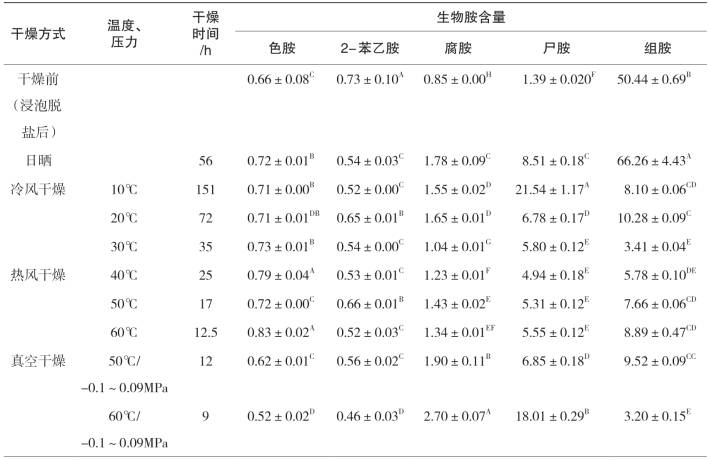
续上表
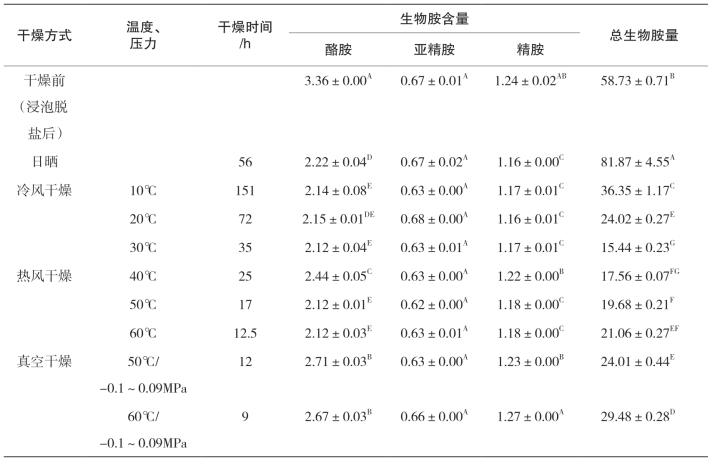
注:同一列同一天字母的不同表示彼此具有显著差异(p<0.05)。
表5-34 不同干燥条件对腌干金线鱼中8种生物胺的影响 单位:mg/kg

续上表
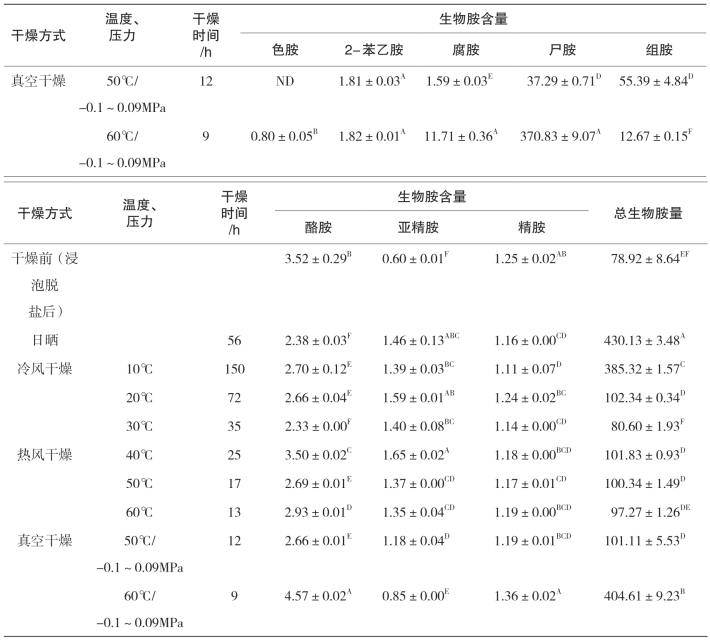
注:ND代表未检出;同一列同一天字母的不同表示彼此具有显著差异(p<0.05)。
(三)腌干鱼制品在贮藏过程中生物胺的变化规律及货架期预测
1. 腌干鱼贮藏过程中理化指标的变化
(1)pH的变化
如图5-70所示,腌干带鱼和金线鱼在贮藏8周内,pH不断下降,带鱼由第0周的6.26下降到第8周的5.52;金线鱼由第0周的6.36下降到第8周的5.71。一方面,带鱼的pH要普遍低于金线鱼,这可能是由于带鱼是高脂鱼,脂肪含量要普遍高于低脂的金线鱼,在贮藏过程中,产生的脂肪酸含量要多于金线鱼;另一方面,在贮藏初期,肌肉中的肌糖原酵解及ATP分解,产生酸性物质,致使鱼体pH 值下降,而贮藏后期,鱼体可能也发生了酸败现象,导致了两种鱼pH的下降。
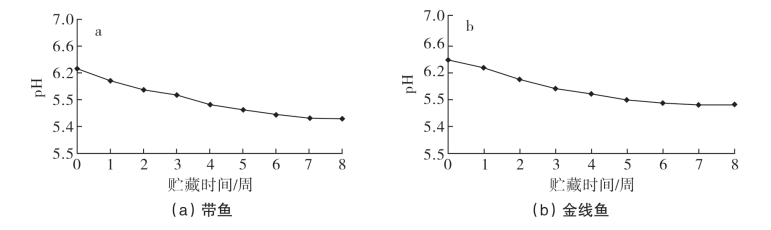
图5-70 腌干鱼贮藏过程中pH的变化
(2)水分含量和Aw的变化
由图5-71可知,腌干带鱼和金线鱼在贮藏过程中水分含量不断下降,在前4周,水分含量下降最为明显,带鱼由第0周的45.96%下降至第4周的10.87%,而金线鱼从第0周的41.36%下降到第4周的9.52%,水分含量分别下降了35.09%和31.84%。这可能是由于鱼体长期处于空气当中,鱼体内的水分在贮藏过程中由于湿度、风等因素慢慢蒸发。从第4周到第8周这4周内,水分含量分别下降到第8周的5.54%和4.20%,处于极干的状态。
同样的,两种鱼的Aw也处于不断下降的状态,带鱼由第0周的0.82下降到第8周的0.36,金线鱼由第0周的0.83下降到第8周的0.43,并且在第5周时,两种鱼的Aw已全部低于0.6,此水分活度下的腌干鱼中已没有多少微生物可以存在。

图5-71 腌干鱼贮藏过程中水分含量和Aw的变化
2.腌干鱼贮藏过程中微生物指标的变化
表5-35和表5-36为两种腌干鱼制品中主要微生物在贮藏过程中的变化情况。
表5-35 腌干带鱼贮藏过程中主要微生物的变化

注:以上均为三个平皿上菌落数的平均值±标准偏差;“< 10”表示在稀释倍数为10的平板上未检出菌落。
表5-36 腌干金线鱼贮藏过程中主要微生物的变化

注:以上均为三个平皿上菌落数的平均值±标准偏差;“< 10”表示在稀释倍数为10的平板上未检出菌落。
由两表可知,乳酸菌、葡萄球菌和微球菌数量最多,是腌干鱼制品中的主要优势菌。带鱼中的葡萄球菌和微球菌在前三周不断上升,由第0周的2.35×103cfu/g上升到第3周的1.55×104cfu/g而后开始下降至第8周为4.00×102cfu/g,而金线鱼中的葡萄球菌和微球菌则是在前两周不断上升,而后则不断下降,同时可以看出在前5周,金线鱼中葡萄球菌和微球菌的数量级要远高于带鱼。乳酸菌为另一大类腌干鱼制品中的优势菌,由表可以看到,带鱼中的乳酸菌在前三周不断上升而后不断下降,至第8周为4.50×10cfu/g,而金线鱼中的乳酸菌也同样如此。
假单胞杆菌和肠杆菌作为腐败菌在腌干鱼制品中也广泛存在,带鱼在贮藏前3周存在假单胞杆菌和肠杆菌而后未被检测出,而假单胞杆菌和肠杆菌在金线鱼中则存在了4个星期,并出现了先上升后下降的趋势。
带鱼中的菌落总数在贮藏过程中先上升后下降,由第0周的3.95×103cfu/g上升到第3周的2.60×104cfu/g而后不断下降,至第8周为1.40×103cfu/g,金线鱼中的菌落总数在贮藏过程中也是先上升后下降,由第0周的1.38×105cfu/g上升至第2周的6.70×105cfu/g,而后不断下降,至第8周为3.55×102cfu/g。主要微生物前期上升后期下降的现象,其原因可能是前期腌干鱼中水分含量和Aw仍处于一个适合微生物生长的合理范围内,而后随着水分含量的不断下降,腌干鱼制品的盐度随着上升,导致了一些不耐盐的微生物死亡,再后来,Aw下降至0.5以下后,则抑制了绝大多数微生物的生长。
3.腌干鱼贮藏过程中生物胺及其相关生物胺指标的变化
图5-72为腌干带鱼和金线鱼在贮藏过程中色胺、2-苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺8种生物胺的变化情况。由图5-72a可以看出,组胺、尸胺和腐胺为带鱼在贮藏过程中的主要胺类物质,其中组胺作为最优势的胺类总体呈不断上升的趋势,由第0周的4.30mg/kg上升至第8周的15.63mg/kg,增加了2.63倍;此外,腐胺作为另一个主要胺类,在第5周达到最大值7.68mg/kg,而尸胺则缓慢上升,由第0周的2.09mg/kg上升到第8周的5.77mg/kg;其他5种生物胺则始终处于较低的值(均低于2.6mg/kg)。由图5-72b可以看出,组胺和尸胺为金线鱼贮藏过程中最主要的两类胺类物质,其次是腐胺。尸胺由第0周的40.30mg/kg上升至第8周的142.46mg/kg,增加了2.53倍,而组胺由第0周的8.92mg/kg上升至第8周的110.32mg/kg,增加了11.37倍。腐胺缓慢上升,8个星期上升了8.24mg/kg,酪胺则从第0周的2.01mg/kg上升到第8周的3.38mg/kg,其余4种生物胺均处于较低的值(均低于2.5mg/kg)。同时可以看到,金线鱼中组胺和尸胺的含量要远高于带鱼,这可能是由于金线鱼中产生物胺菌的数量远高于带鱼,另一方面可能是金线鱼原料本身所含有的生物胺含量较高。
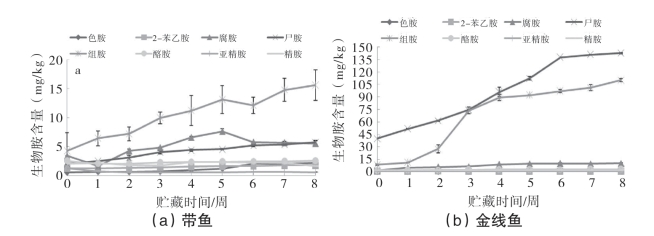
图5-72 腌干鱼贮藏过程中8种生物胺的变化
图5-73为腌干带鱼和金线鱼总生物胺量及其相关生物胺指标贮藏过程中的变化情况。一些学者提出采用某些生物胺及其相关指标的变化来评价鱼类的腐败进程。如图5-73所示,带鱼和金线鱼中的单胺和二胺在贮藏过程中均呈不断上升的趋势,而组织性多胺基本保持不变,其中,在整个贮藏过程中带鱼中单胺>二胺>多胺,而金线鱼则是二胺>单胺>多胺,根据鱼种的不同而不同。有研究采用毛细管电泳仪的方法测定3℃和15℃贮藏条件下鲤鱼肉的生物胺含量,提出二胺可用于评价鲤鱼肉的腐败进程,得出感官可接受等级的二胺限值:< 20 mg/kg,好;20~45 mg/kg,可接受;> 45 mg/kg,差。由于检测方法、鱼种和贮藏温度与本章研究存在很大差异,因此鲤鱼中二胺含量与本章研究的带鱼和金线鱼中二胺范围存在较大差异。
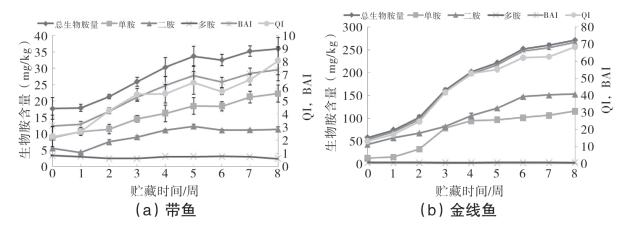
图5-73 腌干鱼贮藏过程中总生物胺量、单胺、二胺、多胺、生物胺指数和质量指数(QI)的变化
图5-73a和图5-73b中,由于公式(组胺+腐胺+尸胺)的存在,总生物胺量、生物胺指数和质量指数的变化趋势相似,在某些生物胺的影响下,曲线出现轻微波动,但不影响总体趋势,尤其是图5-73b。带鱼中总生物胺量除了第6周略有下降外,其余均呈不断上升的趋势,从第0周的17.72mg/kg上升至第8周的36.00mg/kg,增加了约2倍;金线鱼中总生物胺量则呈不断上升趋势,从第0周的57.60mg/kg上升至第8周的271.13mg/kg,增加了3.71倍。从微生物胺的角度可以看出,虽然在贮藏后期,产生物胺的菌含量下降甚至是消失,但只要有产生物胺菌的存在,生物胺含量仍会不断上升,不随着菌体的减少而减少,可见,生物胺的不断增加是一个不断累积的过程。生物胺指数和质量指数(QI)是用于评价其他鱼种在不同贮藏条件下鱼肉腐败进程的指标,它们随着贮藏温度升高而升高,但没有比较一致的评价范围。带鱼中的生物胺指数和质量指数除第6周略有下降外,基本呈不断上升趋势,而金线鱼中的生物胺指数和质量指数则呈不断上升的趋势。关于微生物数量和感官可接受性的相互关系,有研究提出将生物胺总量作为腐败进程评价指标的大体范围,即冷藏罗非鱼片处于新鲜、可接受、腐败时总生物胺量(TBA):< 30 mg/kg、30~60 mg/kg、> 60 mg/kg;生物胺指数:< 20、20~40、> 40;质量指数=1.5是腐败的临界点。本实验中带鱼的总生物胺量、生物胺指数和质量指数范围分别为17.72~36.00mg/kg、12.42~29.60mg/kg和2.28~8.08,金线鱼的总生物胺量、生物胺指数和质量指数范围分别为57.60~271.13mg/kg、53.49~266.66和13.35~68.50,其中质量指数远超过了1.5的冷藏罗非鱼片腐败临界点。因此,由于不同鱼种、不同加工方式、贮藏方式、微生物菌群对生物胺的种类和含量影响较大,需要做更多的研究来确定这个评价范围。
4.腌干鱼贮藏过程中生物胺生成与理化指标、微生物生长的相关性
表5-37是带鱼中生物胺与理化、微生物指标的相关性。
表5-37 带鱼中生物胺与理化指标、微生物的相关性

注:**在0.01 水平(双侧)上显著相关,*在0.05 水平(双侧)上显著相关。
由表可知,除酪胺、亚精胺、精胺和多胺外,其余5种生物胺、总生物胺量及其生物胺相关指标与贮藏时间呈极高度相关性(R=0.680~0.992),其中单胺相关性最高,其次是尸胺和2-苯乙胺;理化指标也与贮藏时间呈高度负相关性(R=-0.928~-0.980),其中Aw负相关性最高;微生物中只有假单胞杆菌与贮藏时间呈显著的负相关性(p<0.05);微生物中除假单胞杆菌与生物胺及其相关指标有相关性外,其他均无相关性,其中,假单胞杆菌与2-苯乙胺、尸胺、组胺、总生物胺量、单胺、二胺和生物胺指数负相关极显著(p<0.01),与色胺、腐胺和质量指数负相关显著(p<0.05);除酪胺、精胺和多胺外,生物胺生成与理化指标也呈高度负相关性,其中,尸胺与3种理化指标相关性最高(R=-0.954~-0.986),其次是单胺(R=-0.941~-0.973),总生物胺量居第三(R=-0.936~-0.974)。
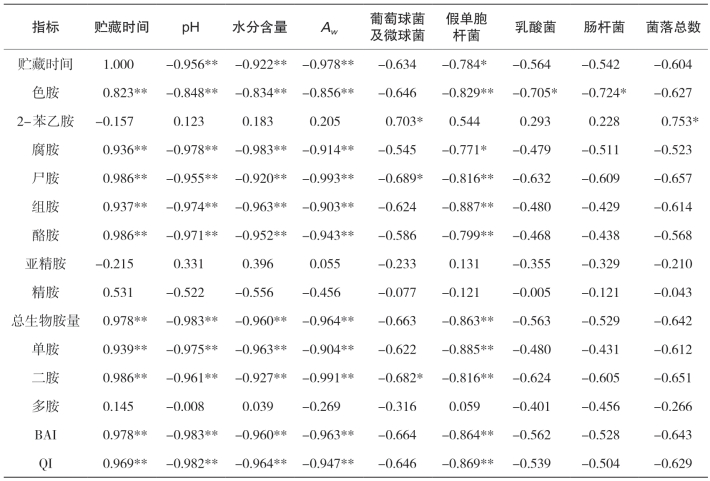
表5-38是金线鱼中生物胺与理化、微生物指标的相关性。
表5-38 金线鱼中生物胺与理化指标、微生物的相关性
注:**在0.01 水平(双侧)上显著相关,*在0.05 水平(双侧)上显著相关。
由表可知,除2-苯乙胺、亚精胺、精胺和多胺外,其余5种生物胺、总生物胺量及其生物胺相关指标与贮藏时间呈极高度相关性(R=0.823~0.986),其中酪胺、尸胺和二胺相关性系数最高,其次是总生物胺量和生物胺指数;理化指标也与贮藏时间呈高度负相关性(R=-0.922~-0.978),其中Aw负相关性最高;微生物中只有假单胞杆菌与贮藏时间呈显著的负相关性(p<0.05);8种生物胺中,微生物生长与色胺负相关性最高,而2-苯乙胺正相关性最高;组胺与假单胞杆菌的负相关性最高,其次是单胺,质量指数居三;除2-苯乙胺、精胺、亚精胺和二胺外,生物胺生成与理化指标也呈高度负相关性。其中,总生物胺量、生物胺指数和二胺最高,其次是组胺和腐胺等。
5.腌干鱼生物胺的货架期预测模型的建立
根据表5-37和表5-38,贮藏时间与生物胺生成、理化指标以及微生物生长的相关性的主要结果,采用逐步回归分析对上述与贮藏时间相关性高(p<0.05)的指标全部选入进行筛选拟合。以贮藏时间为因变量,其他指标为自变量,根据显著大小逐步输入模型中,拟合标准回归系数,进而获得模型的指标、拟合度以及误差等参数,结果见表5-39和表5-40。
表5-39 腌干带鱼多指标的逐步回归分析
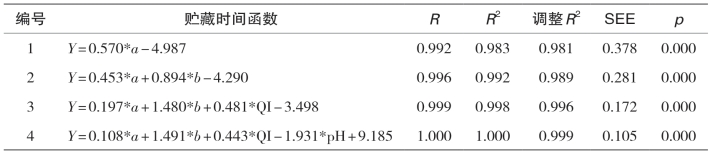
注:a为单胺质量浓度(mg/kg);b为色胺质量浓度(mg/kg);R为相关系数;R2为回归判定系数;修正R2为调整后的判定系数;SEE为标准估计的误差;p为回归模型显著性。下同。
表5-39显示的是腌干带鱼关于贮藏时间的多重回归方程,最终选用4个指标进入模型中,按照显著性:单胺>色胺>质量指数>pH,其中单胺(主要含有组胺)的线性回归判定系数已达到0.983,达到了98.3%的拟合。考虑到pH与贮藏时间高度相关,且线性回归方程不能完整地反映某些指标的非线性变化,因此,使用多元线性回归模型,其预测精度和有效性要高于一元线性回归方程,因此表5-39中的方程4可能更适用于本研究结果。因此,腌干带鱼关于生物胺的货架期回归方程为:Y=0.108*a+1.491*b+0.443*QI-1.931*pH+9.185。
表5-40 腌干金线鱼多指标的逐步回归分析

注:c为酪胺质量浓度。
表5-40显示的是腌干金线鱼关于贮藏时间的多重回归方程,最终共有两个指标进入模型中,分别是酪胺和Aw,显著性:酪胺>Aw。其中酪胺的线性回归判定系数已达到0.973,即酪胺1个变量对于贮藏时间函数的解释能力为97.3%,综合Aw指标能达到99.4%的解释能力,并且误差均小于0.5,方程p值均为0.000,即p<0.001(极显著),表明回归方程的拟合度非常好。因此,腌干金线鱼关于生物胺的货架期回归方程为:Y=3.430*c-7.337*Aw-0.751。
(四) 腌干鱼制品贮藏过程中生物胺的形成机理
综合上述分析,腌干鱼制品贮藏过程生物胺形成机理是:游离氨基酸作为生物胺前体物质对腌干鱼制品加工过程中生物胺的形成影响较大,生物胺的形成与pH、盐度、水分含量等理化因素以及微生物的影响关系较大。腌干鱼制品中生物胺的形成主要在腌制阶段和干燥阶段,其中,腌制阶段,组胺为主要胺类物质,它和总生物胺量随着食盐浓度的增大而降低、随着腌制温度的上升而增大同时随着腌制时间的延长而增大;干燥阶段,尸胺和组胺为主要胺类物质,干燥方式的不同显著地影响着它们的形成。
腌干鱼中的组胺、尸胺、单胺和二胺在贮藏过程中总体呈上升趋势,总生物胺量、生物胺指数和质量指数的变化趋势总体保持一致。组胺和尸胺等主要生物胺、总生物胺量、生物胺相关指标、理化指标以及假单胞杆菌与贮藏时间高度相关,同时绝大多数的生物胺与理化指标和假单胞杆菌也高度相关。腌干带鱼关于生物胺的贮藏回归方程为:Y=0.108*a+1.491*b+0.443*QI-1.931*pH+9.185;腌干金线鱼关于生物胺的贮藏回归方程为:Y=3.430*c-7.337*Aw-0.751。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




